
| Главная |
| Поиск по сайту |
Адрес этой страницы' ?>
<<Предыдущая страница Оглавление книги Следующая страница>>
Глава 10
ГАЛЬВАНИЧЕСКИЕ ПОКРЫТИЯ НИКЕЛЕМ И ЕГО СПЛАВАМИ ПОКРЫТИЯ НИКЕЛЕМ
Микроструктура никелевого покрытия, полученного из электролита Уоттса
Покрытия никелем и его сплавами
Никелевые покрытия применяют в различных отраслях промышленности как в качестве подслоя, так и самостоятельно для защитно-декоративных и специальных целей. Они характеризуются твердостью => 150 кгс/мм2, значительной коррозионной стойкостью и хорошей отражательной способностью (58—62%), удельным электросопротивлением 8,3 • 10-2 Ом•м.
Никелевые покрытия наносят на медь, железо и их сплавы, а также на титан, вольфрам и другие металлы. На стальные детали наносят подслой меди. Покрытия никелем могут быть блестящими, износостойкими, черными. Помимо никелевых широко применяют покрытия такими сплавами, как Ni - Со, Ni - Zn, Ni - Cu, Ni - Ru, Ni — Fe и др.
Обычные никелевые покрытия осаждают из электролита (в г/л):
NiSO4•7H2O 140-200
NiCl2•6H2O 30-40
Н3BO3 25-40
Na2SO4 60-80
Режим электролиза: температура электролита 20—55°С, рН = 5,2, iк = 0,5 ÷ 2,0 А/дм2, аноды — из никеля. Твердость получаемых покрытий 160 — 200 кгс/мм2, сопротивление разрыву 3500-3800 кгс/см2, удлинение 30%, отражательная способность 30-40%. Микроструктура покрытия никелем представлена на рис. 38 и 39.
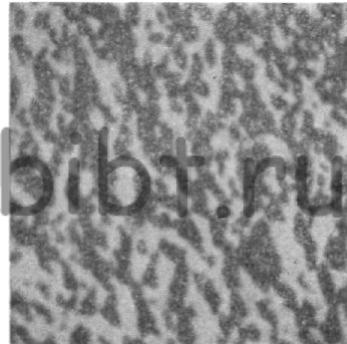
Рис. 38. Микроструктура никелевого покрытия, полученного из электролита Уоттса при 50 °С и iк = 2,5 А дм2 на механически отполированной мели (х 10000)

Рис. 39. Микроструктура никелевого покрытия, полученного из электролита Уоттса с добавкой сахарина 1 г/л и барбитуровой кислоты 0,09 г/л (х 20000)
Блестящие никелевые покрытия получают из электролита (в г/л):
NiSO4•7H2O 250-300
Н3ВО3 35-40
NaCl 10-15
Бутиндиол-1,4 (35%-ный) 0,5
Формалин (40%-ный)0,5-1,0
Хлорамин Б 2,0-2,5
Режим электролиза: рН = 4,5 ÷ 5,5; температура электролита 40±5°С, iк = 2 ÷ 3 А/дм2, рН =5,1 ÷ 5,4. Микротвердость покрытий ~400 кгс/мм2. сопротивление разрыву 4000 — 5000 кгс/см2, удлинение 10— 20%, отражательная способность 65—75%.
Для твердого никелирования используют электролит (в г/л):
NiSO4•7H2O 180
NH4Cl 25
Н3ВО3 30
Режим электролиза: температура электролита 40-55°C, рН = 5,6 ÷ 5,9, iк = 2 ÷ 10 А/дм2, аноды — из никеля. Твердость покрытий 350 — 550 кгс/мм , сопротивление разрыву 10000 кгс/см2, удлинение 5 —8%.
При катодной поляризации никеля (рис. 40) из сульфатного электролита предельный ток iк = 2 А/дм2. При этом потенциал осаждения никеля составляет ~0,07 — 0,1 В. Достигнув предельного тока, катодная поляризационная кривая резко смещается в сторону отрицательных значений, и на катоде наблюдается обильное выделение водорода.
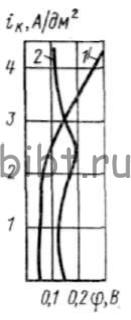
Рис. 40. Кривые катодной поляризации никеля в электролите Уоттса (1) и с добавкой 0,5 г/л бутинлиола-1,4 (2)
Бутиндиол-1,4 в количестве 0,5 г/л сильно влияет на ход катодной поляризации, изменяя равновесный потенциал, а также увеличивает предельный ток. Это объясняется тем, что бутиндиол-1,4 блокирует определенные участки катодной поверхности и тормозит процесс осаждения никеля.
В растворе сернокислого никеля пассивация такого анода наступает при небольших значениях iа. Смещение анодного потенциала в сторону положительных значений увеличивает скорость растворения никеля (активное состояние). В транспассивном состоянии (рис. 41) скорость растворения анода снова повышается, но становится неустойчивой. Незначительное смещение потенциала в сторону положительных значений приводит к еще большей пассивации, которая сопровождается выделением кислорода и уменьшением скорости растворения никеля, что в конечном итоге влечет за собой снижение концентрации ионов никеля в растворе и повышение кислотности в прикатодном слое. На рис. 42 показана зависимость состояния никелевого анода от рН электролита. При малых значениях рН на катоде большая доля тока расходуется на выделение водорода, и процесс никелирования может прекратиться вообще. При больших значениях рН осаждаются хрупкие и шероховатые покрытия, так как происходит защелочивание прикатодного слоя и соосаждение гидратированных солей никеля.
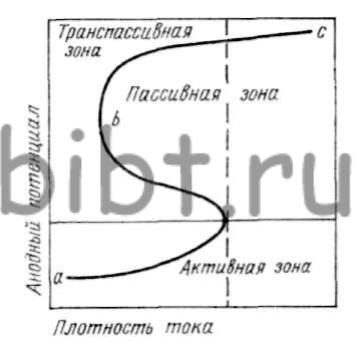
Рис. 41. Схема изменения состояния никелевого анода при постоянных значениях φ и ia (по шкале логарифмов)
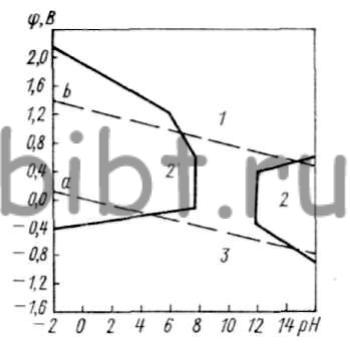
Рис. 42. Зависимость состояния никелевого анода от рН среды:
1 — пассивность; 2 — коррозия; 3 — стойкость
В сернокислых электролитах не следует применять приспособлений (подвесок) из меди, потому что растворяясь, они загрязняют электролит (рекомендуется использовать стальные). Нормальное соотношение Sа:Sк = 2:1. Аноды необходимо предварительно зачищать от шлама стальными щетками и загружать в ванну только в чехлах.
Для улучшения растворимости никелевых анодов в электролиты вводят активаторы NaCl или КСl. Никелевые аноды должны проходить термообработку с целью получения зерен никеля с размерами 40 — 50 мкм, что способствует равномерному растворению анодов. На скорость растворения никеля, а также на качество покрытий не малое влияние оказывает форма анодов. Эллиптические и ромбовидные аноды обеспечивают большую равномерность катодных осадков, чем простые (пластины), кроме того, они более экономичны. По мере растворения ромбовых анодов поверхность при электролизе увеличивается.
Постоянное соотношение анодной и катодной поверхностей в электролите трудно поддерживать в случае применения только растворимых анодов, поэтому рекомендуется увеличивать площадь анодов с тем, чтобы обеспечить лучший выход по току.
При малых значениях iк, низкой температуре, неправильном включении полюсов тока и наличии солей азотной кислоты в электролите никель на деталях не осаждается или они покрываются мажущим черным налетом. Недостаточное обезжиривание деталей, взаимная их экранировка, неправильное расположение анодов или нарушение контакта отдельных анодов приводит к частичному покрытию деталей.
При больших значениях рН и iк покрытие имеет желтый оттенок, а на кромках деталей образуется зеленый осадок гидратов окиси никеля. При больших значениях iк и малой концентрации NaCl аноды покрываются коричневой или черной пленкой.
Губчатые крупнокристаллические покрытия получают при недостатке H2SO4, избытке сернокислой меди или больших значениях iк, а темные полосы на покрытии возникают при наличии мышьяка. Хрупкие покрытия с темными пятнами осаждаются при недостатке серной кислоты в электролите и больших значениях iк. Высокая пористость на покрытии имеет место при пониженной температуре, повышенных значениях iк, загрязнении электролита органическими примесями и солями железа.
Пассивность покрываемого металла возникает при никелировании нержавеющих сталей или никелевых сплавов. Для разрушения пассивной пленки следует вести предварительную катодную обработку в обычной ванне химического обезжиривания с дальнейшей активацией в упомянутых растворах (70 — 80 г/л NaCN) непосредственно перед никелированием.
Перерывы в процессе никелирования приводят к образованию расслаивающихся покрытий с низкой адгезией. Основной причиной образования шероховатых покрытий является загрязнение электролитов шламом, пылью, полировочной пастой и т. д. При непрерывной фильтрации электролит очищается от загрязнений. Шероховатые покрытия получают при накоплении солей кальция и магния (применение артезианской воды). Последние следует отфильтровывать из используемых вод при высоких рН.
Загрязнение никелевых ванн органическими веществами (вследствие попадания масла с деталями, загрязнений от облицовочных материалов ванны, разложения блескообразователей и др.) приводит к получению ряда дефектов на покрытии. Очистку электролитов от таких загрязнений необходимо вести посредством активированного угля.
Примеси хрома (Cr3+) из электролита удаляют, добавляя 1,2 г/л перманганата калия (до исчезновения розовой окраски) и 2,4 г/л основного карбоната свинца и доводя рН до 5,5 с помощью углекислого никеля.
От примесей железа электролит очищают посредством окисления его (при рН = 3,5÷4) и осаждения в виде Fe(OH)3, подщелачиванием до рН = 6. Медь удаляют осаждением на гофрированный катод при iк = 0,1 А/дм2 или посредством фильтрации через слой порошкообразного металлического никеля. Цинк удаляют добавлением взмученного мела или гашеной извести до получения рН = 6,1 ÷ 6,3 с дальнейшей фильтрацией электролита. Недопустимыми примесями в электролитах никелирования также являются (в г/л):
Марганец 0,2
Калий > 0,4
Магний >0,1
Олово > 0,02
Свинец > 0,01
Сера > 0,005
Чем сложнее конфигурация изделий, тем больше разброс толщины никелевого покрытия. Так, при длительном катодном восстановлении никеля (в течение 1 ч), iк = 1 А/дм2 и средней толщине осадка 11 мкм локальное изменение толщин составляет 8 — 18 мкм. Более равномерное покрытие получают при перемешивании электролита. Наибольшее влияние на ухудшение блеска и внешнего вида деталей (особенно малогабаритных) оказывает рН электролита (при повышении вводят разбавленную H2SO4, а при понижении — карбонат никеля или каустическую соду). Слабая адгезия блестящих никелевых покрытий связана с низкой их пластичностью, вызываемой примесями в электролите таких веществ, как гидроокись металлов, железо, цинк и хром (допускается Fe < 0,2, Cu < 0,01, Zn < 0,01, Cr < 0,04 г/л).
Для осаждения никелевых покрытий большой толщины применяют сульфаматный электролит (в г/л):
Ni(NH2SO3)2 350-400
Хлорид никеля 12 — 15
Борная кислота 25 — 40
Режим электролиза: температура электролита 50-60°С, рН = 3,6 ÷ 4,2, iк = 5 ÷ 12 А/дм2; аноды — из никеля; перемешивание интенсивное. Микротвердость покрытий 150—190 кгс/мм2, относительное удлинение 20 — 40%.
В таком электролите ион NH2SO3 подвержен гидролизу с образованием ионов аммония и сульфата. Скорость гидролиза увеличивается с повышением температуры и кислотности электролита.
Футеровку ванн для сульфаматных электролитов, насосы и другое оборудование следует изготовлять из полипропилена, полиэтилена, неопренового каучука, стекла и т. д. Не рекомендуется применять свинец, так как сульфамат свинца растворим в воде, что приводит к быстрому загрязнению оборудования.
Для черного никелирования применяют электролит (в г/л):
Сернокислый никель 50-60
Сернокислый аммоний 15-20
Сернокислый цинк 20-25
Лимонная кислота 2-3
Роданистый аммоний 15-20
Режим электролиза: температура электролита 15-25°С, iк = 0,1 ÷ 0,15 А/дм2, рН = 5 ÷ 5,5, аноды - из никеля. Черный никель осаждают на обычный никель с целью теплопоглощения и придания декоративного вида и для повышения блеска и коррозионной стойкости. Затем пропитывают его индустриальным маслом или покрывают бесцветным лаком.