
| Главная |
| Поиск по сайту |
Адрес этой страницы' ?>
<<Предыдущая страница Оглавление книги Следующая страница>>
Этилендиаминовые электролиты.
Этилендиаминовые электролиты для меднения стальных изделий.
Этилендиаминовые электролиты. Для меднения стальных изделий небольших размеров и несложной конфигурации применяют электролит (в г/л):
CuSO4•5H2O 80-100
(NH4)2SO4 40-50
Na2SO4•10H2O 40-50
En (этилендиамин основание) 50 — 60
Режим электролиза: температура электролита 15 — 25°С, iк = 0,5 ÷ 1,0 А/дм2, аноды — из меди, ηк = 97 ÷ 99%. К недостаткам этилендиаминовых электролитов следует отнести необходимость загрузки деталей под током, известную профессиональную вредность этилендиамина, повышенные начальные значения iк = 5 ÷ 7 А/дм2.
Кривая катодной поляризации меди в электролите при различной концентрации этилендиамина, показывают, что предельный ток возрастает при уменьшении концентрации комплекса. В области высоких iк скорость осаждения меди зависит от концентрации ионов CuEn2+ (рис. 47).
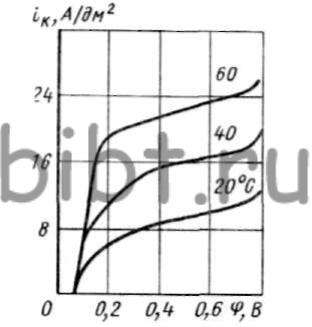
Рис. 47. Кривые катодной поляризации меди в хлоридном этилендиаминовом электролите, содержащем CuCl2 (15 г/л), En (125 г/л) и NaCl (30 г/л)
Значение рН корректируют добавлением NaOH. При увеличении рН электролита потенциал катода смещается в сторону отрицательных значений, особенно при низких плотностях тока. Это связано с тем, что при низких значениях iк происходит разряд ионов Cu2+, при увеличении iк на разряд этих ионов оказывает влияние предшествующая диссоциация комплекса: CuEn2+ -><-Cu2+ +En
При значительном увеличении iк на катоде может идти разряд комплекса:
CuEn2+2 -><- CuEn2+ +En; CuEn2+ + ē -><- CuEn+, CuEn+ + ē -><- Cu + En.
Кинетика осаждения меди из таких электролитов выражается уравнением:
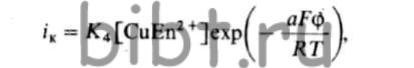
где а — коэффициент переноса; R — газовая постоянная; F - число Фарадея; φ - потенциал электролита; Т— абсолютная температура; Кi - константа, здесь i = 4.
Потенциал растворения анода в этилендиаминовом электролите имеет предельное значение при увеличении концентрации En. С увеличением ia анодные поляризационные кривые сливаются (рис. 48).
![Кривые анодной поляризации меди в электролите, содержащем [CuEn2]SO4 (65 г/л и Na2SO4 (200 г/л),](1-94.jpg)
Рис. 48. Кривые анодной поляризации меди в электролите, содержащем [CuEn2]SO4 (65 г/л и Na2SO4 (200 г/л), при различной избыточной концентрации этилендиамина
При отсутствии избытка этилендиамина анодный процесс протекает без участия молекул En по схеме
Cu -><- Cu+ + ē и Cu -><- Cu2+ + ē.
Минимальное количество дефектов в структуре осадков, получаемых из этилендиаминовых электролитов, наблюдается при тех значениях рН и iк, где электроосаждение меди происходит в результате разряда ионов CuEn2+2, при этом значение рН возрастает до 10.