
| Главная |
| Поиск по сайту |
Адрес этой страницы' ?>
<<Предыдущая страница Оглавление книги Следующая страница>>
КИНЕТИКА КАТОДНОГО ВОССТАНОВЛЕНИЯ СЕРЕБРА
Кинетика катодного восстановления серебра
В большинстве электролитов серебро находится в виде комплексов, например: [Ag(NH3)]+, [Ag(CN)2]-, [Ag(CNS)2]-, [Ag4Fe(CN)6], [Ag(SO3)]2- и др. Мерой стойкости комплексных соединений серебра, как и других металлов, служит константа ионизации, или константа нестойкости Кн. Для перечисленных комплексов константа нестойкости равна соответственно 6,3•10-4, 8•10-22; 0,9•10-10; 8,3•10-11; 5•10-6. Наиболее стойким является цианистый комплекс серебра. Это объясняется тем, что в образовании связей принимают участие все валентные d-орбитали за счет донорно-акцепторного и дативного механизма.
Электролиты, содержащие комплексные соединения серебра, позволяют получать более компактные и мелкозернистые покрытия. Это связано с тем, что потенциалы восстановления серебра из растворов комплексных соединений имеют большие отрицательные значения, чем из растворов простых солей (табл. 32).
32. Нормальные потенциалы восстановления серебра (по отношению к нормальному водородному электроду) при 25°С
| Реакция | φ0, В |
Ag + ē -> Ag |
0,799 |
Ag2SO4 + 2ē -> 2Ag + SO2-4 |
0,653 |
Ag2CO3 + 2ē -> 2Ag + CO2-3 |
0,460 |
Ag(NH3)2 + ē -> Ag + 2NH-3 |
0,373 |
Ag2O + H2O + ē -> 2Ag + OH- |
0,344 |
AgCl + ē ->Ag + Cl- |
0,224 |
Ag4Fe(CN)6 + 4ē -> 4Ag + + Fe(CN)4-6 |
0,194 |
Ag(CNS) + ē -> Ag + CNS- |
0,09 |
AgBr + ē -> Ag + Br- |
0,07 |
AgCN + ē -> Ag + CN- |
-0,04 |
Ag(CN)-2 + ē -> Ag + 2CN- |
-0,29 |
Ag(CN)2-3 + ē -> Ag + 3CN- |
-0,51 |
Ag2S + 2ē -> 2Ag + S2- |
-0,71 |
Теоретический расчет потенциалов восстановления для системы серебро -вода, содержащей простые соли, ведут исходя из рН электролитов и концентрации ионов серебра в электролите. Так, для системы
Ag+ + ē -> Ag
имеем log[Ag+] = 6,33 - рН,
φ = 0,799 + 0,0591 log [Ag+].
Потенциалы восстановления серебра или другого металла из комплексных растворов находят иначе. Так, например, для определения комплексного иона [Ag(CN)2]- сначала подсчитывают концентрацию иона Ag+ по формуле
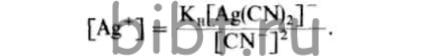
При этом учитываются не только комплексные ионы [Ag(CN)2]-, но и свободные ионы CN-. Затем найденное значение активности ионов [Ag+] подставляется в формулу
φ = φ0 + 0,0591 log [Ag+],
где φ0 = 0,779 В.
В электролитах, содержащих простые соли серебра, катодный процесс в основном сводится к уравнению
Ag+ + ē -> Ag и Н+ + ē -> Н
анодный на растворимых анодах
Ag -> Ag+ + ē
и на нерастворимых анодах (например, в хлоридном электролите)
Cl- -> Cl + ē.