
| Главная |
| Поиск по сайту |
Адрес этой страницы' ?>
<<Предыдущая страница Оглавление книги Следующая страница>>
Железо - коррозионная стойкость.
Выды корозии железа : сплошная, местная, межкристаллитная, подводная, подземная, атмосферная, биокоррозия, коррозионная усталость.
Коррозионная стойкость железа.
Наиболее известными видами коррозии железа и его сплавов являются сплошная, местная, межкристаллитная, подводная, подземная, атмосферная, биокоррозия, коррозионная усталость и др.
Сплошная коррозия железа. В разбавленной H2SO4 этот процесс протекает по уравнениям
Fe = Fe2+ + 2ē, 2Н+ + 2ē = Н2
или
Fe + 2H+ = Fe2+ + Н2.
В щелочных растворах железо корродирует по реакции
Fe + 2NaOH + 2Н2O= Na[Fe(OH)4] + Н2O.
В присутствии кислорода в нейтральных или близких к ним растворах разрушение железа протекает по реакции
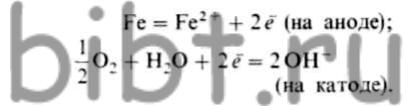
При этом образуется Fe3+, а при недостатке кислорода получается смешанный окисел ферроферрит (Fe3O4 x Н2O). Вода (1 л), насыщенная воздухом, может вызвать коррозию на поверхности (1 см2) железа на глубину => 0,022 мм. Если наряду с выделением водорода происходит кислородная деполяризация, то общая коррозия усиливается (коррозия железа в водопроводной воде, содержащей СО2, опасна только в присутствии кислорода).
Местная или сквозная коррозия железа приводит к появлению кратерообразных углублений и сквозных отверстий при наличии окислительной среды и вещества, способного разъедать окисные пленки (ионы хлора, брома, иода с концентрацией >3* 10-4 г - ион /л).
Стали, легированные кремнием, молибденом и медью, имеют меньше сквозных язв, чем нелегированные. Так, у аустенитных хромоникелевых сталей в 4%-ном растворе NaCl (90 °С) наибольшая глубина язв достигается при рН = 5 ÷ 7, а с введением NaOH снижается от 0,4 до 0,1 г/(м2 • сут.), а их число уменьшается от 14 до 2.
Межкристаллитная коррозия железа приводит к разрушению металла (сплава) по границам зерен и к отрыву последних от общей массы металла (особенно в растворах хлоридов). Разновидностью этой коррозии является нитевидная коррозия (появление узких разрезов вблизи сварных швов, легированных ниобием или титаном). Для предотвращения коррозии углерод в сталях необходимо связывать в карбиды.
К межкристаллитной коррозии железа склонны аустенитные стали (при содержании Ni больше 45% они стойки). Марганец и молибден увеличивают скорость коррозии, а бор (даже ~ 0,4%) уменьшает ее. Межкристаллитная коррозия практически возможна в серной кислоте при потенциалах от 0 до + 0,3 В и имеет максимум при + 0,15 В. Она вызвана обеднением гранул зерен хромом. Поэтому стали, склонные к межкристаллитной коррозии, можно эксплуатировать, если их стационарный потенциал лежит в области устойчивого пассивного состояния.
Графитизация чугуна не изменяет формы деталей и появляется под слоями ржавчины. При этом металлическая связь чугуна в пораженных участках исчезает и остается только решетка графитовых или цементитовых прожилок, погруженных в черно-коричневые продукты коррозии губчатой структуры. Такая коррозия происходит под действием солевых растворов или слабых кислот, а также кислых почв.
Подземная коррозия железа. На уровне грунтовых вод и при низком значении рН в грунте происходит разъедание железа. Чем выше рН грунта, тем выше его электросопротивление и тем слабее коррозия. Коррозия стальной арматуры в бетоне носит электрохимический характер. Образующиеся поры и трещины в бетоне заполняет вода, насыщенная гидроокисью кальция из бетона. При этом коррозия арматуры усиливается за счет неодинакового доступа атмосферного кислорода к различным участкам ее поверхности, а также присутствия хлоридов в воздухе и влаге.
Прокатная окалина, имеющая катодные функции, ускоряет коррозию. Наилучшей защитой стальной арматуры в бетоне от коррозии является цинковое покрытие с хроматной пассивацией. Углеродистые стали в контакте с медью корродируют со скоростью 0,43 - 1,52 мм/год, с никелем - 0,05 - 0,15 мм/год.
Атмосферная коррозия железа. Механизм коррозии углеродистых и низколегированных сталей вначале характеризуется следующими реакциями:
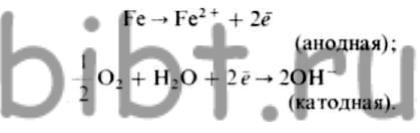
Если среда, содержащая ноны Fe2+, является щелочной, то гидроксилионы, образованные по катодной реакции, попадая на анодный участок, в виде исходного продукта дают белую гидроокись :
Fe2+ + 2OH- -> Fe(OH)2.
В растворах, находящихся в воздушной атмосфере, Fe(OH)2 легко окисляется до FeO(OH) или Fe3O4 в зависимости от рН раствора. В сильнощелочных растворах образуется 4Fe(OH)2+О2 -> 4FeO(OH)+2Н2O, в слабощелочных 6Fe(OH)2 + O2 -> 2Fe3O4 + 6Н2O. Когда водный раствор на поверхности металла нейтрален или имеет слабокислую реакцию, образуются только гидроксильно-кислородные комплексы Fe (II). В атмосфере промышленных районов, содержащей сернистый газ, на поверхности металла образуется ржавчина зеленого цвета (Fe-II), которая затем окисляется, превращаясь в черный окисел Fe3O4.
Погружная коррозия железа. По концентрации солей океанская вода эквивалентна ~3,5%-ному раствору NaCl, а ее рН колеблется в пределах 8,1 -8,3. Скорость коррозии углеродистых сталей в ней ~ 0,10 мм/год.
В водоохлаждающих системах коррозия железа протекает с катодным восстановлением растворенного кислорода. Анодами служат участки с ограниченным доступом O2 (продукты коррозии, различные защитные покрытия и т. д.). Коррозия происходит с образованием язв и приводит к сквозным разрушениям металла. Скорость коррозии стали контролируют по рН воды. При высоких скоростях движения воды происходят коррозия при трении и кавитация. В первом случае на стали возникают подковообразные повреждения (в теплообменниках и других аппаратах). Кавитация приводит к локальным разрушениям вследствие ударов в результате резкого заполнения пустот, образующихся в воде в зонах низких давлений. В таких условиях бихроматы и нитраты повышают потенциалы железа и переводят его в пассивное состояние.