
| Главная |
| Поиск по сайту |
Адрес этой страницы' ?>
<<Предыдущая страница Оглавление книги Следующая страница>>
Получения оловянных покрытий.
Составы электролитов и режимы оловянирования.
Для получения оловянных покрытий применяют щелочные и кислотные электролиты следующих составов (в г/л):
Натрий оловяннокислый 50-100
Натр едкий 10 - 15
Натрий уксуснокислый 15 - 20
Перекись водорода 1-2
Режим электролиза: температура электролита 60 - 70°С; iк = 1÷2 А/дм2, скорость осаждения 10 ÷15 мкм/ч, аноды - из олова (в процессе электролиза аноды должны иметь золотисто-желтый цвет).
Олово сернокислое 40 - 50
Кислота серная 50 - 80
Натрий сернокислый 30 - 50
Препарат ОС-20 2-5
Режим электролиза: температура электролита 20-50°С, iк =1÷ 2 А/дм2, скорость осаждения 25 - 35 мкм/ч, аноды - из олова. Зависимость ηа от iа представлена на рис. 97. Оплавление оловянных покрытий ведут в касторовом масле 200 ±10 °С в течение 1-2 с или в глицерине (950 г/л глицерина и 50 г/л диэтиламина сернокислого) при 250±10 °С в течение 1-2 с. Вместо оловянных анодов можно применять растворимые аноды из стали 12Х18Н9Т.
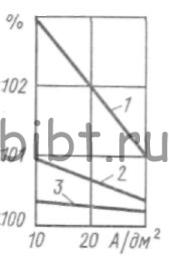
Рис. 97. Зависимость выхода по току от анодной плотности тока 1 и 2 - соответственно олово марки 01 и электролитическое в сернокислом электролите; 3 - электролитическое олово в солянокислом электролите
В щелочных электролитах оловянные аноды покрываются пассивной пленкой, состоящей из двух слоев: внутреннего тонкого, прочно сцепленного с металлом, и внешнего рыхлого, состоящего из гидроокиси олова.
Первой стадией анодного процесса является образование гидроокиси олова
Sn + 20H- -> Sn(OH)2 + 2ē,
которая затем превращается в станнит Sn(OH)2 + ОН- -> HSnO-2 + Н2O.
Накопление Sn(OH)2 и HSnO-2 вблизи поверхности анода приводит к образованию твердой пленки, содержащей 5SnO•2H2O, блокирующей часть его поверхности. Дальнейшее смещение потенциала в сторону положительных значений сопровождается следующей реакцией (вторая стадия процесса):
SnO + 2OН- -> SnO2 + H2O + 2ē.
В результате этой реакции образуется пассивная пленка, и на аноде выделяется кислород. При низких ia практически весь Sn(OH)2 успевает превратиться в станнит. При высоких плотностях тока концентрация Sn(OH)2 быстро повышается, наступает насыщение щелочи, и пленка образуется из насыщенного раствора Sn(OH)2.
Толстослойные покрытия оловом осаждают из электролита (в г/л):
Олово (в виде металла) 90 - 180 КОН (свободный) 45-60
Режим электролиза: температура электролита 70-80° С, iк = 1 ÷ 1,5 А/дм2, аноды - из олова. С целью предотвращения рекристаллизации олова при низких температурах в электролит вводят 0,2% Bi в виде Na2BiO6. Олово в таком электролите представляет собой коллоидный раствор SnO•xH2O.
Для катодного восстановления мелкодисперсных покрытий олова на стали и меди применяют электролит (в г/л):
Сернокислое олово 50 - 55
Фенолсульфокислота 60 - 70
Дифенилпропан 2
Режим электролиза: температура электролита 40-50°С, iк = 1 ÷2 А/дм2; аноды - из олова.
Поскольку с ростом рН значение ηк снижается, рН необходимо поддерживать на определенном уровне, периодически добавляя, например, уксусную кислоту. Но при этом растет концентрация ионов Na+ и уменьшается растворимость станната. Его концентрация становится настолько малой, что процесс восстановления олова на катоде может прекратиться. На практике среднюю концентрацию Na2SnO6 поддерживают равной 150 г/л при длительности электролиза ≈400 А • ч/л. Корректировка электролита осуществляется добавлением SnO2 или периодически введением золя гидроокиси олова. При осаждении олова с применением нерастворимых анодов вместо Na2SnO6 следует использовать K2SnO6 в силу его большей растворимости.
Наибольшее применение нашел следующий хлоридный электролит (в г/л):
SnCl2 50-60
NaF 35-40
НС1 (свободная) 3 - 4
Желатина 2
Фенол 5
Режим электролиза: температура электролита 35-45°С, iк = 3 ÷ 5 А/дм2, аноды - из олова. Такой состав электролита и режим электролиза применяют для покрытия крепежа.
Блестящее лужение осуществляют в электролите, содержащем (в г/л):
SnSO4 80-100
H2SO4 140-160
Фенол 30-40
Клей столярный 1
Режим электролиза: температура электролита 15 -25°С, iк = 2 - 3 А/дм2, аноды - из олова.
Для осаждения оловянных покрытий применяют триполифосфатный электролит, обладающий хорошей рассеивающей способностью и позволяющий покрывать детали сложной конфигурации. Состав электролита (в г/л):
SnCl2 100-110
К5Р3О10 600-700
NH4C1 70-90
KJ 0,5
Клей столярный 5 - 8
Режим электролиза: температура электролита 15 -25°С, iк = 0,5 ÷1,0 А/дм2, аноды - из олова, катодный выход при этом составляет 60%. Кривые катодной поляризации из такого электролита представлены на рис. 98. Триполифосфат калия и NH4C1 несколько снижают предельный ток, а декстрин и столярный клей смещают стационарные потенциалы осаждения олова в сторону отрицательных значений. Добавив KJ, можно полностью устранить процесс анодного окисления в триполифосфатном электролите.
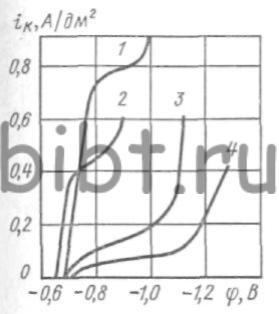
Рис. 98. Кривые катодной поляризации олова из хлоридного электролита (рН = 8,5 и 20°С) состава (г/л): 7-112 г/л SnCl2•2H2O и 720 г/л К5Р3О10; 2-112 г/л SnCl2•2H2O, 720 г/л К5Р3О10 и 90 г/л NH4Cl; 3 - то же, с добавкой 2 г/л декстрина; 4 - то же, с добавкой 8 г/л столярного клея
В большинстве электролитов оловянирования анодный процесс идет более беспрепятственно, чем катодный, в результате чего в растворе происходит постепенное увеличение концентрации ионов олова. Зависимость накопления ионов олова от времени электролиза представлена на рис. 99.
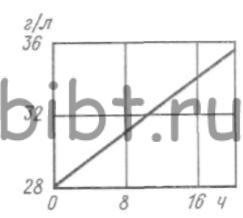
Рис. 99. Зависимость накопления ионов олова в электролите от времени
В радиотехнике используют электролит (в г/л):
SnCl2 80-100
Na4P2O7 150-200
NH4C1 50-70
Режим электролиза: температура электролита 20 -30°С, iк = 0,8 ÷ 1,0 А/дм2, аноды - из олова, катодный выход по току равен 85 - 90% при iк = 0,8 А/дм2. Осадки получаются мелкозернистыми, светлыми и надежно сцепленными с основой. Катодный выход по току в основном зависит от содержания Na4P2O7 в электролите (рис. 100).
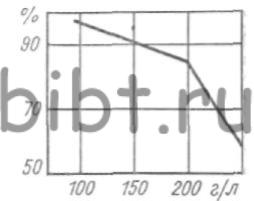
Рис. 100. Зависимость выхода по току олова от концентрации Na4P2O7
Понижая ηк и смещая стационарные потенциалы осаждения олова, Na4P2O7 при прочих равных условиях электролиза способствует получению покрытий с более мелкой кристаллической структурой, чем из щелочных или кислотных электролитов.