
| Главная |
| Поиск по сайту |
Адрес этой страницы' ?>
<<Предыдущая страница Оглавление книги Следующая страница>>
КИНЕТИКА КАТОДНОГО ВОССТАНОВЛЕНИЯ ЗОЛОТА
Щелочные цианидные электролиты для золочения.
Электролиты золочения подразделяют на цианидные и нецианидные. Цианидные электролиты бывают щелочными, нейтральными и кислыми. Обычно золото в цианидные электролиты вводят в виде комплекса KAu(CN)2 (дицианоаурат). В щелочных и нейтральных электролитах золото находится в виде аниона [Au(CN)2]-. В кислых электролитах при рН <= 3,0 одновалентный комплекс цианида золота разлагается с образованием AuCN и KAu(CN)2. Последний при таких значениях рН устойчив.
Щелочные цианидные электролиты.
При измерении катодной поляризации золота в концентрированных электролитах, содержащих Au (34 г/л) и KCN (5 - 10 г/л) обнаруживаются пять отдельных участков (рис. 110). При разбавлении электролита значения предельных токов понижаются, что связано с увеличением степени диссоциации комплексных анионов и повышением концентрации свободных ионов золота. Уменьшение концентрации KCN влияет на скорость катодного процесса аналогично увеличению общей концентрации электролита.

Рис. 110. Кривые катодной поляризации золота в цианистом электролите:
1 - 34 г/л Au, 10 г/л KCN, 34,5 г/л К2СO3; 2 - двукратное разбавление; 3 - пятикратное разбавление; 4 - 30 г/л Au, 4, 3 г/л KCN и 30 г/л К2СO3
Если проследить за ионизацией золотого анода в данном электролите:
2Au + 4KCN + O2 + 2Н2O -><- 2KAu(CN)2 + 2KOH + 2Au + 4KCN + Н2O2 -><-2KAu(CN)2 + 2KOH,
то можно обнаружить, что растворение поляризованного анода зависит только от диффузии кислорода к его поверхности независимо от увеличения концентрации свободного цианида (до 70 г/л). Поэтому кроме количества кислорода, восстановленного на катоде, на снижение ηк влияет скорость растворения золотого анода.
Понижение ηк при переходе с IV на V участок поляризационной кривой сопровождается восстановлением на катоде водорода и изменением внешнего вида покрытия: на III участке оно плотное с золотистым отливом, а на IV и V участках - коричневое и губчатое. С увеличением концентрации свободного цианида до 70 г/л (при содержании золота в электролите, равном 30 г/л) значение потенциала понижается на 0,19 В. Это свидетельствует о том, что при малой концентрации свободного цианида в прикатодном слое (в результате ионизации золота) значительно повышается концентрация комплексных ионов с меньшим координационным числом. Наряду с обычными щелочными цианидными электролитами применяют электролиты для блестящего золочения.
Блестящие покрытия имеют более мелкозернистую структуру с явно выраженным поликристаллическим строением. Такие покрытия при постепенном их наращивании быстрее приобретают собственную структуру, чем обычные.
Наиболее известными блескообразователями для цианидных электролитов золочения являются тиомочевина, добавка серебра, оксид сурьмы, пропилен-диамин и др. Блескообразователи способствуют сдвигу катодной поляризации в сторону отрицательных значений, не изменяя при этом равновесный потенциал осаждения золота (рис. 111). Тиомочевина способствует уменьшению предельного тока и значения потенциала осаждения золота.
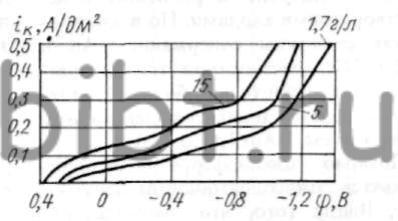
Рис. 111. Кривые катодной поляризации золота:
1 -без добавок; 2 - 0,7 г/л тиомочевины