
| Главная |
| Поиск по сайту |
Адрес этой страницы' ?>
<<Предыдущая страница Оглавление книги Следующая страница>>
ОБЩИЕ СВЕДЕНИЯ О ЭЛЕКТРОХИМИИ МЕТАЛЛОВ
ПОНЯТИЕ О ЭЛЕКТРОЛИЗЕ И ЭЛЕКТРОЛИТАХ
Понятие о электролизе и электролитах
При подключении к полюсам источника постоянного тока, например, двух металлических пластин, погруженных в раствор кислоты или щелочи, в гальванической батарее наблюдается появление электрического тока. Одновременно на металлических пластинах происходят определенные реакции. Так, в случае применения платиновых пластинок и растворов щелочей или кислот на пластинке, присоединенной к положительному (отрицательному) полюсу, выделяется кислород (водород). Этот процесс получил название электролиза, а раствор — электролита.
Находящиеся в электролите ионы под действием электрического тока принимают строго направленное движение: катионы — к катоду, анионы — к аноду, т. е. ионы служат переносчиками электрического тока в электролитах и называются электропроводниками II класса.
В транспортировке электричества через раствор участвуют все ионы, но в передаче его от раствора к металлу (электродам) — лишь некоторые анионы и катионы. Следовательно, электропроводность электролитов и переход электричества от раствора к металлу и от металла к раствору являются отдельными процессами. Например, на катоде могут разряжаться нейтральные молекулы (NO2 + ē -> NO-2; Ag(CN) + ē -> Ag + CN-), которые остаются в электрическом поле неподвижными и в переносе электричества участия не принимают, в то время как приходящие к катоду (аноду) положительно (отрицательно) заряженные катионы (анионы) могут совершенно не разряжаться на электродах.
Количество
проходящего через электролит электричества определяется числом
кулонов, т. е. произведением силы тока (в амперах) на время (в
секундах). Сила тока I, как правило, выражается законом Ома: I = Е/R,
где Е — напряжение или разность потенциалов. Электрическое
сопротивление 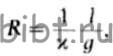 где l — расстояние между электродами; g — площадь сечения
столбика электролита.
где l — расстояние между электродами; g — площадь сечения
столбика электролита.
Величина "и" есть электропроводность столбика электролита длиной 1 см и сечением 1 см2. Однако эта величина не пригодна для сравнения электропроводности разных электролитов, так как зависит от концентрации раствора. Для этой цели пользуются электропроводностью электролита, приведенной к 1 г•экв/л или 1 г• моль/л называемой эквивалентной λ или молярной Λ:

где Сэ и См — концентрации соли, кислоты или основания, г•экв/л и г • моль/л.
С помощью этих величин легко вычислить степень диссоциации электролита α— полный или частичный распад веществ, входящих в раствор.
Соотношение между количеством прошедшего через раствор электричества во время электролиза и количеством прореагировавших веществ на электродах определяется законами Фарадея, которые составляют основу гальваностегии. Первый закон гласит о том, что между количеством прошедшего через электролит электричества Q и количеством прореагировавшего в электрохимической реакции вещества или количества выделившихся на электродах продуктов реакции Δm существует зависимость: Δm = qQ = qIt,
где q — коэффициент пропорциональности; I — сила тока; t — время.
При I = 1А и t = 1 с Δm = q. Коэффициент q называют электрохимическим эквивалентом или количеством вещества, выделившегося на электродах, при прохождении через систему 1 Кл электричества.
Второй закон говорит о том, что при прохождении через электролиты одного и того же количества электричества массы прореагировавших веществ на электродах прямо пропорциональны их химическим эквивалентам:
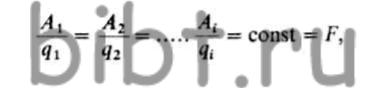
где F - константа Фарадея. Ее значение, например, для серебра равно 96 500 Кл.
Следовательно, для превращения 1 г•экв любого вещества необходимо пропустить через электролит 96 500 Кл электричества.
Для определения влияния побочных электрических реакций применяется понятие выхода по току, которое выражается уравнением:
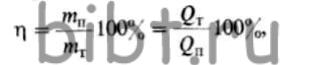
где mп — практически прореагировавшее количество вещества; mт — теоретически подсчитанное количество вещества, которое должно было прореагировать в соответствии с законом Фарадея: QT— количество прошедшего электричества, вычисленное по закону Фарадея; Qп — практически израсходованное количество электричества.
Толщину покрытия, продолжительность электролиза и плотность тока вычисляют по формуле
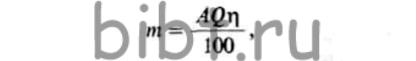
где A — электрохимический эквивалент; η — выход по току.
Так как масса m= Vρ (где V— объем выделившегося металла; ρ — плотность металла), a V= gd, где g — общая площадь гальванопокрытия; d - его толщина, толщину (в мкм) находят по формуле
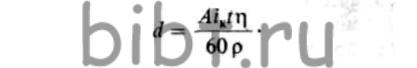
По этой же формуле можно определить катодную плотность тока iк (в А/дм2) и t (в мин).
Во время электродных реакций, вызываемых электрическим током, электроны на аноде освобождаются, а на катоде связываются. Вследствие этого на аноде происходят электрохимические реакции окисления, а на катоде — восстановления.
При погружении металла в электролит, содержащий ионы данного металла, на границе фаз металл — электролит возникает разность потенциалов, называемая электродным потенциалом. Этот потенциал обусловлен зарядами ионов, которые имеются как в электролите, так и в металле.
При отсутствии внешнего электрического поля переход ионов из металла в электролит и обратно быстро достигается равновесие ионов и устанавливается постоянный потенциал (гальвани-потенциал). Абсолютное значение гальвани-потенциала любого электрода определяется относительно другого, вспомогательного электрода, например относительно нормального водородного электрода, гальвани-потенциал которого условно обозначен 0,0000 В (при активности водородных ионов 1 и давлении газа 1 кгс/см2). Электродный потенциал зависит от температуры, валентности и концентрации (или активности) ионов металла в электролите.
При переходе ионов на электрод изменяется свободная энергия системы металл-электролит ΔF. Эта энергия определяется осмотической работой, получаемой при переходе иона от активного состояния а0 к состоянию активности а:

где R — газовая постоянная; Т— абсолютная температура.
Значение ΔF можно приравнять к максимальной электрической работе при постоянном объеме -ΔF=zFφ (где z — валентность иона; F — константа Фарадея). Тогда получим

При R = 8,31 Дж. F = 96 500 Кл, Т=298 К это уравнение примет следующий вид:
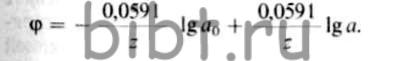
Первый член правой стороны уравнения состоит из постоянных величин, и его можно обозначить константой φ0, тогда
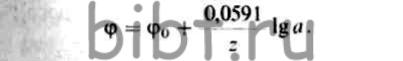
Эта формула называется уравнением Нерста и выражает потенциал любого металла, погруженного в раствор своих ионов, активность которых равна а (при а = 1 φ = φ0). Величину φ0 называют нормальным, или стандартным, потенциалом электрода.
При динамическом равновесии между металлом и электролитом основные ионы, определяющие потенциал электрода, с одинаковой скоростью переходят к электроду и от него, поэтому скорость анодного и катодного процессов равна iк = iа = i0, где i0 — ток обмена, характеризующий скорость процессов на электроде при равновесном значении электродного потенциала, т. е. при отсутствии внешнего тока.
Ток обмена зависит от вида, состава и концентрации электролита. При поляризации электрода (пропускание внешнего тока, например плотностью i) его потенциал приобретает значение φi, отличное от потенциала φе (без тока). Отклонение электродного потенциала от него равновесного значения называется перенапряжением η = φi-φе.
Анодная поляризация электрода (i> 0) вызывает положительное перенапряжение, а катодная (i < 0) — отрицательное. Если при отсутствии внешнего тока одновременно происходит несколько электродных реакций, например ионизация и осаждение металла (Me -> Zē -><- Mez+ ), ионизация и разряд ионов водорода (Н2-2ē -><- 2Н+), тогда образуется средний, так называемый компромиссный электродный потенциал φкп.
При анодной и катодной поляризации электрода аналогично равновесному изменяется и компромиссный потенциал. В этом случае отклонение электродного потенциала от значений равновесных потенциалов приводимых реакций называется не перенапряжением, а поляризацией η=φп-φкп, где φп — потенциал поляризации. Поляризация, как и перенапряжение, есть функция плотности тока i. Если при одновременном течении нескольких электродных реакций ток обмена одной реакции значительно выше тока обмена другой, то компромиссный потенциал приближается к равновесному потенциалу более быстрой электродной реакции.
Простая катодная реакция может быть расчленена на следующие четыре последовательные ступени, или процесса.
Миграция ионов из массы раствора к внешней границе диффузионного слоя под действием электрического поля.
Скорость этого процесса [число грамм-ионов (г•ион), проходящих ежесекундно через 1 см2 площади сечения электролита]
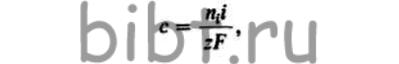
где ni — число переносов ионов.
Скорость перехода разряжающихся ионов (в г•ион/л) через каждый сантиметр сечения раствора под действием электрического поля и градиента активности ионов (миграция плюс диффузия) выражается уравнением
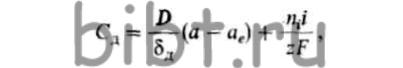
где D — коэффициент диффузии ионов; δд — толщина диффузионного слоя, см; а, ае — активность ионов в массе раствора и в контакте металла с электролитом.
Когда другие ступени электродной реакции происходят быстро, переход разряжающихся ионов через диффузионный слой может тормозить общую электрохимическую реакцию. Такое торможение называют диффузионным перенапряжением и вычисляют по формуле
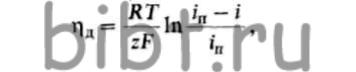
i — плотность применяемого для электролиза тока; iп — предельный ток, при котором скорость разряда ионов равна скорости их притока к поверхности катода путем диффузии и миграции.
Среднюю толщину диффузионного слоя принимают равной 0,05 см. Тогда предельный ток в неперемешиваемых электролитах (при 20 °С) определяют по приближенной формуле iп= 0,025za1, где a1 — активность разряжающихся ионов в растворе, которая для приближенных расчетов может быть заменена их концентрацией Сi.
Переход ионов через двойной электрический слой под действием потенциала разряда, градиент которого является наиболее высоким в данном слое.
Имея в виду, что почти весь спад электрического потенциала происходит в двойном электрическом слое, и принимая, что толщина этого слоя равна нескольким атомам, нетрудно подсчитать, что градиент потенциала в нем достигает десятков миллионов вольт на сантиметр. Поэтому в двойном электродном слое происходит взаимодействие вещества с электричеством (в сущности только эта ступень и является настоящей электрохимической реакцией).
В анодном процессе к двойному электрическому слою поступают нейтральные или слабозаряженные атомы металла, а выходят из него в диффузионный слой полностью сформировавшиеся ионы, имеющие ближайшую гидратную оболочку. В катодном процессе, наоборот, к двойному электрическому слою подходят из диффузионного Пространства гидратированные ионы и полностью освобождаются от этой оболочки или комплексообразующих лигандов. Поэтому переход ионов через двойной электрический слой часто затрудняет электродную реакцию, обусловливает ее скорость и вызывает так называемое переходное перенапряжение ηп, являющееся также функцией плотности тока. Его определяют для анодного и катодного процессов:
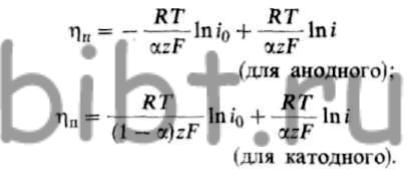
В обоих случаях уравнения имеют форму эмпирического уравнения Тафеля:
![]()
где а и b — константы, определяемые опытным путем.
Если скорость электродной реакции обусловлена только скоростью перехода ионов через двойной электрический слой, то, отложив значения ηп по одной оси координат, а log i — по другой, получают прямую Тафеля, по наклону которой определяют константу b. Для анодного процесса b=2,303RT/αzF, а для катодного 2,303/RT(1-α)zF. Из этих равенств вычисляют произведение αz, а с учетом валентности переходящих ионов и коэффициент переноса а. Если прямую Тафеля провести до ее пересечения с осью координат при ηп=0, то можно получить значение тока обмена. Уравнения переходного перенапряжения для обоих процессов выведены без учета дзета-потенциала, образующегося в диффузионном слое. Хотя во многих случаях он является незначительной величиной по сравнению с общим электродным потенциалом φ, его исключение иногда может привести к значительным погрешностям определения значений а и i0.
Электронейтрализация ионов и освобождение их от гидратированной воды и адсорбция на катоде с последующим вступлением в кристаллическую решетку составляет только часть процесса электрокристаллизации. Другую часть составляет образование двух- или трехмерных зародышей кристаллизации, вокруг которых происходит рост кристаллов металла. Поэтому процесс электрокристаллизации также оказывает влияние на потенциал электрода и на скорость катодной реакции и характеризуется величиной, называемой перенапряжением кристаллизации ηк.
В случае образования двухмерных зародышей перенапряжение кристаллизации определяют по уравнению
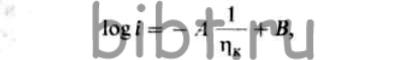
где А и В — константы; ηк< 0.
Следовательно, с повышением перенапряжения кристаллизации число двухмерных зародышей увеличивается, а зернистость электроосадков уменьшается. Для определения перенапряжения кристаллизации при образовании трехмерных зародышей применяют уравнение
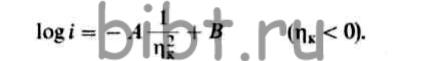
Кроме указанных перенапряжений существует реакционное, или химическое перенапряжение, которое вызвано замедлением отдельных этапов катодной реакции. Например, [Cd(CN)4]2- +2ē -> Cd + 4CN-.
Эта реакция состоит из трех отдельных реакций:
[Cd(CN)4]2- -> Cd(CN)2 + 2CN-;
Cd(CN)2 + 2ē -> Cd + (CN)22-;
(CN)22- -> 2CN-.
Вторая реакция является электрохимической и при определенных условиях может явиться тормозом общей электродной реакции и сместить электродный потенциал. Реакционное перенапряжение ηr в значительной степени зависит от изменения концентрации участвующих в химической реакции веществ, которые являются составной частью механизма общего катодного процесса, и связано с диффузионными явлениями. Поэтому значение ηr часто объединяют с диффузионным перенапряжением и называют концентрационным перенапряжением ηс = ηд + ηr.
Таким образом, перенапряжение электродной реакции состоит из следующих перенапряжений отдельных ее ступеней:
η=ηп+ηк+ηс.