
| Главная |
| Поиск по сайту |
Адрес этой страницы' ?>
<<Предыдущая страница Оглавление книги Следующая страница>>
ЭЛЕКТРОКРИСТАЛЛИЗАЦИЯ И ЕЕ ЗАКОНОМЕРНОСТИ
Схема образования кристаллических зародышей на катоде.
Электрокристаллизация и ее закономерности
Последней стадией катодной реакции при электроосаждении любого металла является адсорбция его атомов на поверхности катода с последующим внедрением их в кристаллическую решетку гальваноосадков. Эту стадию принято называть электрокристаллизацией. Ее следует расчленять на два этапа:
1) образование на определенных местах катодной поверхности кристаллических зародышей или центров кристаллизации;
2) их рост до кристаллитов, размеры которых в гальвано-осадках в основном определяются условиями катодной реакции.
Допустим, что вследствие флюктуации адсорбированных атомов осаждаемого металла на грани ABCD (рис. 7 см. ниже) любого кристалла на катоде кратковременно образовались два кристаллических зародыша: маленький К1 и значительно больше К2. Для сохранения этих зародышей и их дальнейшего спонтанного роста необходима определенная энергия, которая может быть выражена потенциалом поляризации катода или перенапряжением.
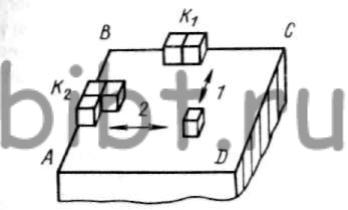
Рис. 7. Схема образования кристаллических зародышей на катоде (ABCD - грань кристалла, осаждаемого на катоде)
Зависимость потенциала зародыша φ от его размеров h можно описать уравнениями, аналогичными уравнению Томпсона - Гиббса для давления паров маленьких капель жидкости:
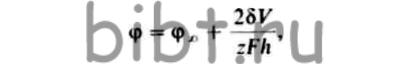
где φ∞ - электродный потенциал бесконечно большого кристалла осаждаемого металла: δ - удельная поверхностная энергия зародыша в контакте с раствором; V - молекулярный объем металла; z - заряд ионов металла; h - размер зародыша, имеющего сферирическую полигональную форму.
При свободной электрокристаллизации новые адсорбирующиеся атомы а электроосаждаемого металла могут с одинаковой степенью вероятности диффундировать в двухмерном пространстве как к зародышу К1, так и к зародышу К2, вступая в кристаллические решетки. Однако кристаллические зародыши легче всего образуются на углах и ребрах растущих кристаллов, так как на этих местах отмечается наибольшее сгущение линий электрического поля. Поэтому степень заполнения разных граней кристаллов атомами или ионами металла неодинакова, и энергия образования кристаллических зародышей, или перенапряжение электрокристаллизации является функцией индексов граней.
Наиболее медленно растут грани (III) кристаллов, состоящих из кубических гранецентрированных решеток и грани (0001) кристаллов с гексагональными плотно упакованными решетками. Рост тонких слоев кристаллов происходит при последовательном образовании слоев металла примерно 10-5 - 10-4 см толщины на соответствующих гранях. Однако электрокристаллизация и кристаллизация гальванических покрытий зависят от вида покрытия, условий электролиза (состав электролита, плотность тока, температура и др.) металла и шероховатости поверхности подложки. Так, серебро осаждается слоями со скоростью 0,0004 мм/мин, медь со скоростью ~0,0002 мм/мин, олово - 0,0008 мм/мин. При этом рост кристаллов происходит только на определенных активных участках с последующим распространением по грани.
По степени трудности восстановления ионов на катоде металлы условно можно разделить на три группы. К первой группе относятся металлы, восстанавливающиеся с низким перенапряжением (олово, кадмий, цинк, медь, серебро и др.). Выделение таких металлов происходит в основном на активных участках катода без заметной химической поляризации.
Металлы, восстанавливающиеся с высоким перенапряжением (Fe, Co, Ni, Cr, Mn и др.) склонны к пассивированию. Существование на катоде такой пленки вследствие адсорбции чужеродных частиц повышает перенапряжение и позволяет осаждать такие металлы из некоторых их солей. При этом покрытия не отличаются высокой чистотой и содержат примеси в виде окиси, гидроокиси, водорода и др.
К третьей группе относятся металлы, которые пока не удается получать из водных электролитов (молибден, вольфрам, ниобий, титан, тантал, магний и др.). Для этих металлов характерна повышенная реакционная способность по отношению к среде и образование поверхностных соединений. Они выделяются на катоде в виде тонкого слоя окиси или гидроокиси.