
| Главная |
| Поиск по сайту |
Адрес этой страницы' ?>
<<Предыдущая страница Оглавление книги Следующая страница>>
ПОКРЫТИЯ РЕНИЕМ И ЕГО СПЛАВАМИ
Микроструктура покрытии рением на меди
Кривые катодной поляризации рения
Гальванические покрытия рением и его сплавами
Рениевые покрытия широко используют в электронной промышленности вследствие высокой температуры плавления и низкой летучести. Окислы образующиеся на поверхности рения, обладают высокой проводимостью, что и определяет применение этих покрытий для изготовления электрических контактов, нитей накаливания, термопар и др. Осадки рения, нанесенные на молибден и вольфрам, предотвращают вторичную эмиссию этих металлов, что существенно для ряда изделий электронной техники. Осаждение рения ведут из электролита (в г/л):
KReO4 10-15
H2SO4 10-15
MgSO3(NH2)2 25-30
(NH4)2SO3 25-30
Температура 60-85 °С, рН = 1-1,5, iк = 10 ÷ 15 А/дм2, перемешивание умеренное, аноды — из платины. С увеличением рН электролита блеск и пластичность покрытий сильно снижаются, и они становятся темными. При понижении температуры и iк ухудшается внешний вид и механические свойства покрытий. На рис. 13 дана микроструктура гальванического рения.

Рис. 13. Микроструктура покрытии рением на меди (х 10 000)
Сульфат аммония увеличивает проводимость электролита и ηк, особенно при низких iк (рис. 14 и 15). Серная кислота способствует снижению рН электролита и получению блестящих и светлых покрытий и увеличению выхода рения по току, а сульфат магния снижает внутренние напряжения в них.
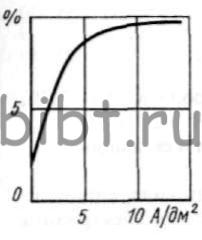
Рис. 14. Зависимость выхода по току от плотности тока в сульфаматном электролите ренирования

Рис. 15. Зависимость выхода по току от температуры сульфаматного электролита ренирования
На рис. 16 и 17 показаны кривые катодной поляризации восстановления водорода и рения из сульфаматного электролита различной концентрации. Добавки сульфаминовой кислоты резко сдвигают катодную поляризацию водорода в сторону отрицательных потенциалов.
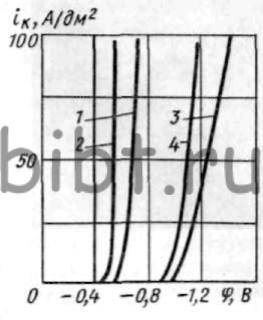
Рис. 16. Кривые катодной поляризации выделения водорода в сульфаматном электролите:
1-25 г/л H2SO4; 2 - 100 г/л H2SO4; 3 - 50 г/л (NH4)2SO4; 4-100 г/л (NH4)2SO4
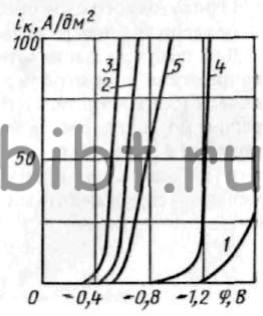
Рис. 17. Кривые катодной поляризации рения в сульфаматном электролите KReO4 50 г/л:
1 — без добавок; 2 — 50 г/л H2SO4; 3-100 г/л H2SO4;4-100 г/л (NH4)2SO4; 5 - 200 г/л (NH4)2SO4 и H2SO4 до рН-1
При осаждении рения на никель на поверхности покрытий образуется пленка черных, зеленых или серых продуктов коррозии. Для предотвращения такого явления покрытия подвергают отжигу при 700°С в восстановительной атмосфере или катодной обработке в серной кислоте. Рениевые покрытия наносят на титан, тантал, сталь, медь, графит. Для получения покрытий толщиной > 25 мкм ведут многократное наращивание тонких слоев с термообработкой каждого слоя.
Катодное восстановление рениевых покрытий ведут из аммиачного электролита (в г/л):
Перренат калия (KReO4) 1—2
Лимонная кислота 50 — 60
Аммиак до рН 9,5
Температура раствора 60 —70°С, iк = = 8 А/дм2, аноды — из платины. При этом выход по току ηк = 2%.
При получении рениевых покрытий необходимо учитывать влияние внутренних напряжений и склонность их к растрескиванию. Восстановление рения происходит согласно реакции
KReO4 + 0,5H2O -><- Re + 1,75O2 + КОН (φ=1,1В).
Восстановление водорода, например, в сульфаматном электролите происходит при φ = 1,48 В. Это означает, что теоретически выделение рения должно происходить перед разрядом ионов Н+. Однако выделение рения на катоде практически начинается при φ => 1,49 В.
Под действием ультразвуковых колебаний существенно изменяются структура и свойства рениевых покрытий. Так, количество включенного в покрытие водорода в ультразвуковом поле снижается в 2 раза, а отрыв пузырьков водорода от катода значительно ускоряется и, следовательно, уменьшается экранизация катода.
Параметры решетки рениевых покрытий, полученных в ультразвуковом поле, приближаются к параметрам решетки отожженного рения. Кроме этого ультразвук уменьшает количество макро- и микропор в покрытиях, при толщине покрытия 10 мкм они практически без пор. При применении ультразвука значительно расширяется интервал рН, в котором получаются качественные покрытия; рН прикатодного слоя стабилизируется и поддерживается равным ~ 1,5.
Для получения покрытий рения без напряжения в электролит вводят соли никеля или кобальта. При этом выход рения по току составляет ~ 90% и покрытия содержат до 15% никеля или кобальта. Для этой цели применяют сернокислотный электролит (в г/л):
KReO4 15-20
NiSO4 5-8
(NH4)2SO4 50-60
Температура электролита 60 —70° С, iк = 2 ÷ 4 А/дм2, рН = 2,5 ÷ 3,0, аноды — из платины или платинированного титана.
Сплав рений — медь, содержащий до 5% меди, получают из электролита (в г/л):
KReO4 40-50
H2SO4 65-75
(NH4)2SO4 40-45
CuSO4•5H2O 1-2
Температура 75°C, iк = 70 ÷ 100 А/дм2, аноды — из платины.
Осаждение рения с хромом ведут из электролита (в г/л):
KReO4 25-30
H2SO4 70-80
(NH4)2SO4 40-50
CrO3 10-15
Температура электролита 20 —30°С, iк. = 80÷ 100 А/дм2. Осадки наносят на медь или никель. Микроструктура сплава рений — хром представлена на рис. 18.
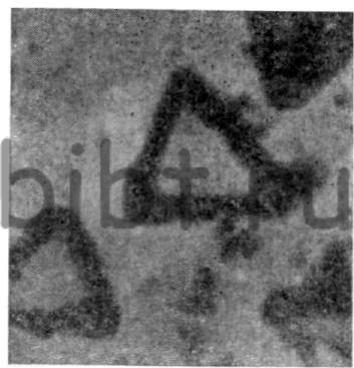
Рис. 18. Микроструктура покрытия сплавом рении — хром на меди (х 10000)