
| Главная |
| Поиск по сайту |
Адрес этой страницы' ?>
<<Предыдущая страница Оглавление книги Следующая страница>>
Глава III. Теоретические основы газовой сварки.
§ 1. Сварочное пламя. Схема строения газокислородного пламени. Распределение температур в нормальном ацетилено-кислородном пламени.
При сгорании горючих газов или паров горючих жидкостей в смеси с технически чистым кислородом (или воздухом) образуется сварочное пламя. Строение ацетилено-кислородного пламени показано на рис. 6. Оно характерно также для большинства газокислородных смесей.
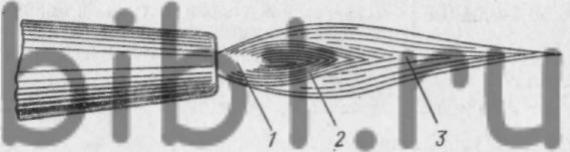
Рис. 6. Схема строения газокислородного пламени: 1 -ядро, 2-восстановительная зона, 3 - факел пламени
В зависимости от соотношения смеси ацетилено-кислородное пламя может быть нормальным, науглероживающим (ацетиленистым) и окислительным (рис. 7).
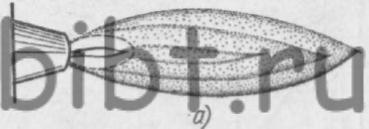
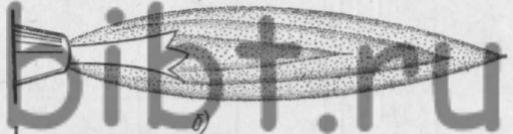

Рис. 7. Виды ацетилено-кислородного пламени: а - нормальное, б - науглероживающее, в - окислительное
Ацетилен сгорает в смеси с чистым кислородом по следующей реакции: C2H2+O2 = 2CO+H2
Продукты неполного сгорания догорают за счет кислорода окружающего воздуха по реакции 2СО+Н2+1,5O2=2СO2+Н2O
Таким образом, на 1 объем ацетилена требуется 2,5 объема кислорода.
Практически вследствие
некоторой загрязненности чистого кислорода нормальное пламя
образуется при несколько большем количестве чистого кислорода, т. е.
при соотношении смеси 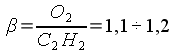
При соотношении смеси 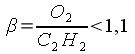 пламя становится науглероживающим. Ядро его увеличивается,
приобретает расплывчатое очертание и начинает коптить. В таком
пламени ощущается недостаток кислорода для полного сгорания
ацетилена. При соотношении смеси
пламя становится науглероживающим. Ядро его увеличивается,
приобретает расплывчатое очертание и начинает коптить. В таком
пламени ощущается недостаток кислорода для полного сгорания
ацетилена. При соотношении смеси 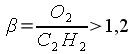 пламя
становится окислительным. Ядро пламени укорачивается и заостряется.
Избыточный кислород в этом случае окисляет железо, а также примеси,
находящиеся в стали.
пламя
становится окислительным. Ядро пламени укорачивается и заостряется.
Избыточный кислород в этом случае окисляет железо, а также примеси,
находящиеся в стали.
Аналогично, сгорание пропана в кислороде также происходит в две фазы:
1. С3Н8+1,5O2 = 3СО+4Н2 (в чистом кислороде)
2. 3CO+4H2+3,5O2 = 3CO2+4H2O (за счет кислорода воздуха)
Как видно из реакций, на один объем пропана требуется пять объемов кислорода:
Сгорание бутана в кислороде происходит по следующим реакциям:
1. С4Н10+2О2=4СО+5Н2 (в чистом кислороде)
2. 4CO+5H2+4,5O2 = 4CO2+5H2O (за счет кислорода воздуха) Из, реакций видно, что на один объем бутана требуется шесть с половиной объемов кислорода.
Природный газ (метан) сгорает в кислороде по реакциям:
1. СН4+0,5О2=СО+2Н2 (в чистом кислороде)
2. СО+2Н2+1,5O2=СO2+2Н2O (за счет кислорода воздуха) На один объем метана требуется два объема кислорода.
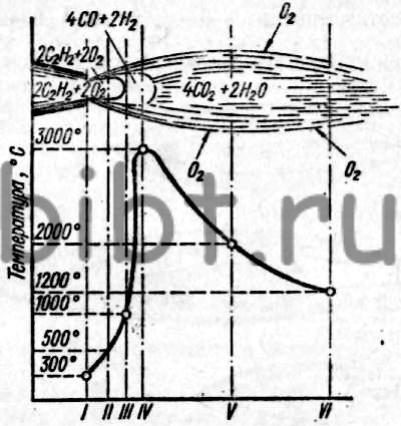
Рис. 8. Распределение температур в нормальном ацетилено-кислородном пламени: I - зона выхода из сопла горелки, II -ядро пламени, III - зона конца ядра, IV- восстановительная зона, V - факел, VI - хвостовая часть факела
При сгорании 1 кг бензина следует затратить 2,6 м3 кислорода. На полное сгорание 1 кг керосина требуется 2,55 м3 кислорода.
Распределение температур в нормальном ацетилено-кислородном пламени показано на рис. 8. Химический состав нормального ацетилено-кислородного пламени приведен в табл. 9.
9. Химический состав нормального ацетилено-кислородного пламени
| Части пламени | Содержание по объему, % | ||||||
| CO | H2 | CO2 | H2O | N2 | O2 | прочие | |
Вблизи конца ядра |
60 | 31 | - | - | 8 | - | Остальное |
В конце восстановительной зоны |
33 | 15 | 9 | 6 | 33 | - | » |
В средней части факела |
3,7 | 2,5 | 22 | 2,6 | 58 | 8 | » |
Вблизи конца факела |
- | - | 8 | 2,2 | 74 | 15 | » |
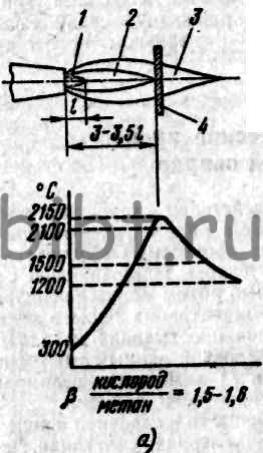
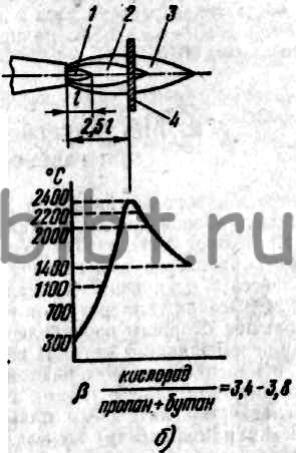
Рис. 9. Распределение температур метан-кислородного (а) и пропан-бутан-кислородного (б) пламени: 1 - ядро, 2 - восстановительная зона, 3 - факел, 4 - свариваемый металл, l - длина ядра
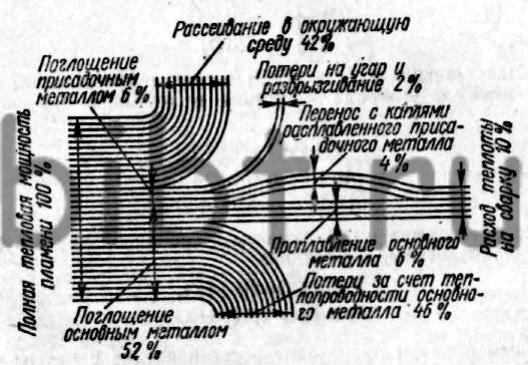
Рис. 10. Тепловой баланс газового пламени при нормальном процессе сварки