
| Главная |
| Поиск по сайту |
Адрес этой страницы' ?>
<<Предыдущая страница Оглавление книги Следующая страница>>
СОСТАВЫ ЭЛЕКТРОЛИТОВ И РЕЖИМЫ ЗОЛОЧЕНИЯ
Зависимость износостойкости золотого покрытия от плотности тока.
Составы электролитов и режимы золочения
В табл. 38 указаны условия получения золотых покрытий.
38. Составы электролитов и режимы электролиза для получения золотых покрытий.
| Состав электролита | Анод | Концентрация, г/л | Температура, °С | iк,А/дм2 | ηк, % | рН |
| Золото
(металл) Лимонная кислота |
Pt | 8-16 80-100 |
45-50 | 3,0 | 95 | 3-3,5 |
| Золото
(металл) KCN (свободный) |
Au | 8-10 80-90 |
20 | 0,5 | 95-98 | 11-11,5 |
| 8 48 60 |
60 | 1,0 | 95 | 10,5-11 | ||
| Золото
(металл) K4Fe(CN)6 •3H2O Na2CO3 |
||||||
| KAu(CN)4 Бикарбонат калия Фосфат калия |
Сталь 12X18H9T | 5-10 15 5 |
70 | 1,0 | 95 | - |
| Фульминат
золота NaCN (свободный) Фосфат натрия |
Au | 20 7,5 30 |
60-70 | 1,0 | 95 | 10-11 |
| 30 150 |
50-70 | 1-2 | 80 | 11-12 | ||
| KAu(CN)2 KCN (свободный) |
||||||
| 5 30-90 10 10 |
40 | 0,8 | 76 | - | ||
| Au
в виде сульфата Этилендиамин (20%-ный раствор) (NH4)2SO4 Na2SO4•10H2O |
||||||
| 15 15 |
60-70 | 0,2 | 95 | 11-11,5 | ||
| KAu(CN)2 KCN (свободный) |
||||||
| HAuCl4•4H2O K4Fe(CN)6 Na2CO3 |
Pt | 2-3 15 15 |
25 | 0,8 | 40 | 10 |
| 6 8 5 |
25 | 0,5 | 90 | - | ||
| Золото
(металл) KCN (свободный) Na2HPO4 |
||||||
| 8 | ||||||
| Na2S2O3 | ||||||
| KAu(CN)2KCN (свободный) | Au | 7-10 15-35 | 60-70 | 0,2-0,3 | 95-98 | 11-11,5 |
| 50 200 50 |
70 | 2-4 | 90-95 | - | ||
| HAuCl4•4H2O K4Fe(CN)6•3H2O Na2CO3 |
Продолжение табл. 38
Состав электролита |
Анод | Концентрация, г/л | Температура, °С | iк, А/дм2 | ηк,% | рН |
| KAu(CN)2 KCN (свободный) NaHCO3 Na3PO4 |
Au | 5 70 35 100 |
98 | 5-10 | 95 | - |
| 3-5 3-5 |
60-70 | 0,2-0,3 | 90 | 9-10 | ||
| KAu(CN)2 KCN (свободный) |
||||||
| 100 500 500 |
70 | 0,9 | 80 | 5,2-5,8 | ||
| KAu(CN)2 (NH4)2HPO4 K2HPO4 |
||||||
| KAu(CN)2 Цитрат натрия или лимонная кислота |
Pt | 8 70 |
20 | 1,0 | - | 3,6 |
| HAuCl4•4H2O K4Fe(CN)6•3H2O Na2CO3 KCNS |
Au | 4 200 65 70 |
60 | 0,3 | 80 | - |
| KAu(CN)2 Лимонная кислота |
Pt | 8 80 |
70 | 1,0 | 80 | 3-5 |
Цианистые электролиты. Почти все цианистые электролиты используют при повышенных температурах (выше 30 °С) и катодной плотности 0,1 - 0,2 А дм2; при больших значениях iк необходимо перемешивание. Анодный процесс в таких электролитах (аноды золотые) зависит от концентрации свободного цианида и iк. Так, при KCN < 1% и iк=>0,2 А/дм2 ηа составляет ~ 2%, при низких iа он равен ~ 100%. Такая зависимость объясняется тем, что при малой плотности iа в раствор поступает меньше ионов золота и они более интенсивно связываются в комплексы типа [Au(CN)2]-.
Дицианоаурат и цианид калия высокой чистоты или К2СO3 значительно активируют золотые аноды. Замена цианида калия цианидом натрия или введение в электролит NaAu(CN)2 вместо KAu(CN)2 полностью пассивируют поверхность золотых анодов. Фосфорнокислые соли натрия, вводимые в нейтральные электролиты, способствуют равномерному растворению анодов и увеличению ηа до 100%.
Оптимальное количество золота в электролитах равно 2 - 10 г/л и 60 г/л при осаждении покрытий большой толщины. Увеличение концентрации золота и температуры электролита позволяет вести электролиз при повышенной плотности iк (0,2 - 0,4 А/дм2). Однако это приводит к излишним потерям золота.
Золотые аноды склонны к пассивированию, поэтому нередко применяют нерастворимые аноды. Идеально нерастворимые аноды из платины дороги. Угольные аноды, растворяясь, загрязняют электролит. Наиболее применимыми являются аноды из платинированного титана или стали 12Х18Н9Т. При работе с нерастворимыми анодами требуется частая корректировка электролита растворимыми солями золота (дицианоауратом калия или золотохлористоводородной кислотой).
В табл. 38 приведено большое число электролитов золочения, однако многие из них не нашли широкого применения. Это связано с тем, что получение качественных покрытий при длительной работе электролита зависит от факторов, не всегда поддающихся регулированию или контролю. Так, при повышенных температурах допустимы большие плотности iк, но при этом необходима усиленная вентиляция, потому что имеют место значительные потери электролита в вентиляционные каналы. Увеличение концентрации свободного цианида способствует лучшей растворимости золотых анодов и обеспечивает получение мелкозернистых покрытий, но при этом повышается токсичность и карбонизация электролитов.
Покрытия, полученные при 20°С и iк = 0,2 А/дм2, имеют светло-коричневый налет, легко удаляемый последующим глянцеванием или галтовкой. При 60-70°С и iк<=0,3 А/дм2 золотые покрытия имеют золотисто-желтый оттенок, а при iк > 0,3 А/дм2 - коричневатый.
Наилучшей твердостью (90 кгс/мм2) обладают покрытия, восстановленные на катоде при iк= 0,2 А/дм2 и 20°С.
Большую износостойкость имеют покрытия, полученные при iк = 0,1 А/дм2 и 20°С (рис. 114).
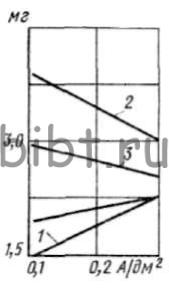
Рис. 114. Зависимость износостойкости золотого покрытия от плотности тока (обозначения см. рис. 110)
Для покрытия деталей из меди и ее сплавов (по подслою серебра) применяют электролит (в г/л):
KAu(CN)2 3-5
KCN (свободный) 40-50
К2СO3 20-60
Режим электролиза: температура электролита 60 -70°С, Sа:Sк=1:10, iк=0,3 ÷ 0,4 А/дм2. Золочение малогабаритных деталей в барабанах и колоколах ведут в электролите, содержащем KAu (CN)2 (4,5 - 6 г/л) и KCN свободный (20-35 г/л).
Режим электролиза: температура электролита 55 - 60°С, iк = 0,3 А/дм2, аноды - из золота, частота вращения барабана 15 об/мин. Выход по току ηк составляет 75 - 80%.
Кислые цианидные электролиты применяют при изготовлении печатных схем и деталей, состоящих из металла и керамики. Наиболее оптимальным является электролит, содержащий KAu(CN)2 (8-10 г/л) и лимонную кислоту (800- 100 г/л).
Режим электролиза : температура 65 - 70°С,рН = 3,5÷5,5, iк = 0,5 ÷ 1 А/дм2, аноды - из платины.
Наиболее широко применяемым цианидферратным электролитом является следующий (в г/л):
НAuСl4•4Н2O 40-50
K4Fe(CN)6 150-200
Na2CO3 50
Режим электролиза: температура электролита 60-70°С, iк = 2 ÷ 3 А/дм2, аноды - из золота. Такие условия электролиза применяют для получения покрытий большой толщины.