
| Главная |
| Поиск по сайту |
Адрес этой страницы' ?>
<<Предыдущая страница Оглавление книги Следующая страница>>
Глава 1
ОБЩИЕ СВЕДЕНИЯ О КОРРОЗИИ МЕТАЛЛОВ И СПЛАВОВ
ТЕОРИЯ КОРРОЗИИ МЕТАЛЛОВ И СПЛАВОВ
Зависимость степени коррозии металла от рН среды.
Теория коррозии металлов и сплавов
Коррозия обычно начинается с адсорбции микрочастиц агрессивной среды на поверхность металла. Степень адсорбции зависит от удельной поверхности контактирующих фаз и размеров микрочастиц (<=10-4 см). Микрочастицы агрессивной среды взаимодействуют с поверхностью металла за счет химической адсорбции или некоторых физических факторов.
Химическая адсорбция характеризуется диссоциацией адсорбированных молекул при взаимодействии с твердым телом. Водород, кислород или азот адсорбируются на поверхности металлов в виде атомов. Адсорбция газа или пара является началом коррозии.
Физические факторы (температура среды, давление, влажность и т. д.) обеспечивают протекание химической адсорбции. Так, при низких температурах последняя не может протекать в силу того, что потенциальный барьер, необходимый для ослабления валентных связей в молекулах, гораздо выше средней энергии теплового движения. Кроме того, между адсорбированным слоем газа (пара) и окружающей атмосферой (газовой средой) должен существовать постоянный обмен.
При постоянной температуре степень адсорбции газа на поверхности металла есть функция давления газа. Динамическое равновесие устанавливается при равенстве скоростей адсорбции и десорбции. Но в действительности при усилении коррозии процесс адсорбции зависит от скорости химической реакции, поэтому защита металлов от коррозии должна основываться на ускорении десорбции (отрыв адсорбированных частиц от поверхности металла).
В результате коррозии изменяется поверхность металла и уменьшается энергия его решетки при взаимодействии с адсорбированным веществом. Атомы металла, расположенные в плоскости дефектной решетки, находятся почти в свободном состоянии. Сохраняя избыток электронов, они легче образуют внешние связи и в дефектах решетки активизируют химические реакции.
Коррозию можно рассматривать как химическое или электрохимическое взаимодействие металла с коррозионной средой. На поверхности металла с помощью электростатических сил удерживаются ионы со знаком, противоположным знаку заряда данного металла, в результате чего образуются участки, на которых сосредотачивается коррозионный процесс.
Следовательно, для защиты металла от коррозии необходимо увеличивать десорбцию ионов посредством снижения образующейся разности потенциалов. На поверхности металла при адсорбции его ионов возникает так называемая ионная атмосфера, область которой оказывает влияние на адсорбцию. Чем больше ионная атмосфера, тем меньшая вероятность адсорбции ионов, особенно в дефектных промежутках решетки металла. В таком случае для защиты металла от коррозии необходимо, чтобы область ионной атмосферы адсорбированных ионов была больше. Другим путем борьбы с коррозией является уменьшение максимума потенциала поверхности металла, возникающего при адсорбции, поскольку пониженные потенциалы соответствуют большим размерам ионной атмосферы.
Согласно электрохимической теории коррозии при наличии на поверхности металла покровного слоя катодная и анодная составляющие коррозионного процесса пространственно разделены, что обусловливает (при наличии влаги) разность значений рН на отдельных участках корродирующего образца. В результате катодной реакции образования иона гидроксила рН возрастает, а реакция анодного растворения металла приводит к снижению рН.
Такими реакциями являются гидротация ионов металла и образование твердых продуктов коррозии при участии воды:
Ме2+ + Н2O + В- -> МеОНВ + Н+,
где В — любой анион.
Исследование коррозионных реакций с образованием твердых продуктов коррозии и успешное прогнозирование коррозии возможно при наличии полной характеристики твердых фаз, образующихся в системе Ме2+ |Н2O| В.
Металл, покрывающийся на воздухе окислом, корродирует в кислородосодержащей воде или растворе соли МеВ с образованием термодинамически устойчивого продукта коррозии в виде окисла МеО. Дополнительно может образоваться метастабильная гидроокись Ме(ОН)2 (рис. 1 см. внизу страницы).
В системе Ме2+(Н2O)В кроме окиси устойчивыми соединениями являются МеВ2 и МеОНВ (рис. 2). Если металл, покрытый окислом, поместить в воду или раствор инертной соли, анион которой не взаимодействует с ионами металла, то пространство вблизи металла насыщается окислом. Ионы металла, взаимодействуя с ионами гидроксила на катоде, могут образовывать окисел, который располагается на существующем покровном слое и способствует прекращению коррозионного процесса (рис. 3, а см. внизу страницы).
В случае возникновения метастабильной гидроокиси скорость коррозии зависит от формы образования этого соединения. Слой гидроокиси менее компактен, и коррозия металлов в этом случае выше, чем при образовании слоя окисла. Если гидроокись неполностью закрывает поверхность металла, то он подвергается локальному язвенному разъеданию (рис. 3, б см. внизу страницы).
В системе только с одним устойчивым продуктом коррозии, когда локальная анодная плотность тока превышает критическое значение, окисный слой на анодных участках снова исчезает (рис. 3, в см. внизу страницы). Это значение определяется падением значения рН вследствие гидролиза ионов металла. Система только с одним устойчивым продуктом коррозии чувствительна к внешним механическим воздействиям, так как площадь катодных участков образца во время коррозионного процесса практически не уменьшается и всегда способна обеспечить ток, необходимый для растворения металла. Поэтому механическое воздействие на поверхность металла приводит к увеличению коррозии.
Большинство металлов и сплавов подвержено электрохимической коррозии, протекающей при различных электродных потенциалах, в результате которой происходит ионизация атомов металла и восстановление окислительной компоненты коррозионной среды.
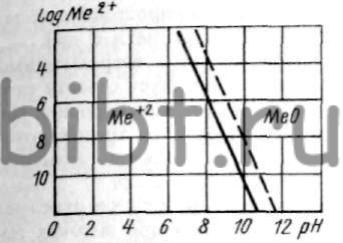
Рис. 1. Зависимость степени коррозии металла от рН среды

Рис. 2. Зависимость состояния металла от рН среды
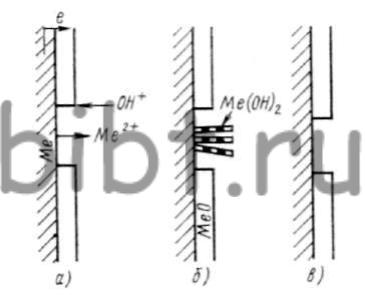
Рис. 3. Схема окислительно-восстановительной реакции на поверхности металла:
а — переход металла в ионное состояние; б — образование окисла металла; в — образование гидроокиси металла