
| Главная |
| Поиск по сайту |
Адрес этой страницы' ?>
<<Предыдущая страница Оглавление книги Следующая страница>>
ЦИАНИСТЫЕ ЭЛЕКТРОЛИТЫ МЕДНЕНИЯ.
Цианистые электролиты меднения
Общеизвестным является состав (вг/л):
NaCu(CN)2 40-50
NaCN (свободный) 10 — 20
Режим электролиза: температура электролита 15 —25°С, iк = 0,5 ÷ 1,0 А/дм2, аноды — из меди, Sa: Sк = 2 :1, ηк=50 ÷ 70% (при iк = 1 А/дм2 ηк = 60%).
Осадки получаются микрокристаллическими, но матовыми, требуют механического полирования. Медные покрытия из такого электролита применяют при глубокой вытяжке как подслой на стальных, латунных и бронзовых деталях, работающих при повышенной температуре или подвергающихся горячей пайке.
Для придания покрытиям более светлого оттенка в электролит вводят гипосульфит (Na2S2O3) 0,2 — 0,3 г/л, а также применяют реверсирование тока (tк: ta = 10:1). При реверсировании исключаются появление дефектов и пассивация медных анодов.
Введение в электролит цианистого меднения сегнетовой соли (40 — 50 г/л) способствует повышению iк до 4 А/дм2 и устраняет пассивацию анодов. Но при этом технологический процесс усложняется, так как температура должна быть повышенная (50 —60°С).
Для получения блестящих медных покрытий под никель (при трехслойном покрытии Cu — Ni — Cr) применяют цианистый электролит (в г/л):
CuCN 80-90
KCN (свободный) 5 — 7
KCNS 40-45
Фурфуриловый спирт 0,3—0,6
Режим электролиза: температура электролита 60-70°С; iк = 2÷4 А/дм2; ηк = 80 ÷ 92%; аноды — из меди; Sа:Sк = 1 : 1; фильтрация электролита непрерывная. Скорость осаждения меди при iк = 4 А/дм2 составляет 1 мкм/мин.
Предварительное меднение изделий из высокопрочной стали ведут в электролите (в г/л):
CuCN 50-55
NaCN (свободный) 20-25
NaOH 15-20
NaCN (общий) 90-100
Режим электролиза: температура электролита 55 —60°С, iк = 0,5 ÷ 0,8 А/дм2, аноды — из меди.
Основными компонентами цианистых электролитов является цианистая медь и свободный цианид натрия. Свободный цианид способствует равномерному растворению медных анодов, обеспечивает необходимую электропроводность и рассеивающую способность электролита.
Медь в цианистых электролитах с наибольшей легкостью образует комплекс [Cu(CN)3]2-. При этом концентрация свободных ионов меди равна 10-25 — 10-29 моль/л, и на катоде разряжаются только цианистые комплексные ионы. Они имеют полярную структуру и, деформируясь под воздействием тока, электростатически притягиваются катодом. Выход по току в цианистых электролитах 75 — 85%. Чем выше содержание CN- в электролите, тем ниже ηк и тем сильнее выделение водорода. Это объясняется образованием комплексов с более высоким координационным числом типа [Cu(CN)4]3- или [Cu(CN)5]4-, из которых медь осаждается труднее. Полностью избавиться от свободных цианидов нельзя, так как это приводит к пассивации анодов и прекращению поступления ионов меди в раствор.
Растворение и осаждение меди в цианистых электролитах происходит следующим образом:
CuCN + NaCN = Na[Cu(CN)2] Na[Cu(CN)2] + NaCN -><- Na2[Cu(CN)3] и т. д.
[Cu(CN)3]2- -> [Cu(CN)2]- + Cu-[Cu(CN)2]- -> Cu + 2CN-.
Кривые катодной поляризации (рис. 45) в цианистом электролите подтверждают, что первый предельный ток соответствует iк = 0,2 ÷ 0,3 А/дм2, а второй — iк = 0,5 А/дм2. Медь восстанавливается при отрицательных потенциалах. В первом случае осаждение меди на катоде происходит из ионов типа Cu(CN)-2 или непосредственно из CuCN, а во втором — из более стойких комплексных ионов типа Cu(СN)2-3 и др. При этом в последнем случае вместе с медью на катоде обильно выделяется водород. Добавка KCNS повышает 1-й предельный ток.
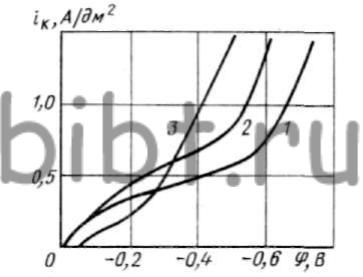
Рис. 45. Кривые катодной поляризации меди из электролита, содержащего Cu (60 г/л) и NaCN (5 г/л) при 50°С:
1 — без добавки; 2, 3 — соответственно 1 и 10 г/л KCNS
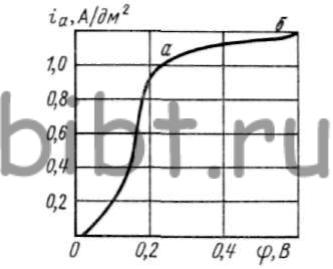
Рис. 46. Кривая анодной поляризации меди в цианистом электролите, содержащем Cu (60 г/л) и NaCN (5 г/л)
Кривая анодной поляризации меди имеет два перегиба (рис. 46). В зоне а медный анод покрывается белым осадком, в то время как в зоне б наблюдается образование осадка голубого цвета.
При рН = 13,3 медный анод приобретает свойства нерастворимого. Сегнетова соль способствует образованию одновалентных ионов меди и увеличивает плотность тока, при которой наступает пассивирование анода. Шламообразование в цианистых электролитах не является таким отрицательным явлением, как например в сернокислых, поэтому можно применять литые или катаные аноды марки М-1.