
| Главная |
| Поиск по сайту |
Адрес этой страницы' ?>
<<Предыдущая страница Оглавление книги Следующая страница>>
Покрытие сплавом медь — олово (бронза).
Гальванопокрытие сплавом медь - олово (бронза).
Сплав медь — олово (бронза). Покрытия желтой бронзой содержат < 20% Sn, а белой бронзой > 40% Sn. Покрытия желтой бронзой применяют в основном для защиты стальных изделий от коррозии в среде холодной и кипящей водопроводной воды. При толщине покрытия => 20 мкм даже после 30 суток непрерывного испытания коррозия основы не появляется. Покрытия белой бронзой не обеспечивают надежной защиты стали от коррозии в силу большого количества пор и микротрещин. Однако они нашли широкое применение для декоративных целей вместо никеля, а также для замены серебра при гальваническом покрытии некоторых типов контактов.
Желтую бронзу осаждают из электролита (в г/л):
Cu (в виде металла) 25 — 30
Sn (в виде металла) 25-30
NaCN (свободный) 15-20
NaOH (свободный) 7-10
Режим электролиза: температура электролита 40-60°С, анод - из меди М0, iк = 0,3 ÷ 0,5 А/дм2. При низких iк практически весь ток расходуется на выделение меди и водорода. В основном выход сплава по току составляет 85 — 90%. Микротвердость бронз (10—15% олова) находится в пределах 200 — 300 кгс/мм2, удельное электрическое сопротивление равно 0,3 — 0,6 • 10-4 Ом • м.
Для получения бронзовых покрытий, применяемых в качестве подслоя под хром, используют электролит (в г/л):
CuSO4•5H2O 30-35
SnSO4 35-40
Фенолсульфоновая кислота 70-80
Режим электролиза: температура электролита 20°С, iк = 0,5 ÷ 1 А/дм2, аноды — из бронзы (~10% Sn). При этом ηк = 80 ÷ 100%, а осадки имеют до 20% Sn.
Для защиты стали от азотирования и воздействия горячей воды и пара бронзовые покрытия наносят из электролита (в г/л):
SnCl4•5H2O 100-120
CuCl 30-40
K4Fe(CN)6 180-200
K2CO3 20-25
NaOH 15-20
Режим электролиза: температура электролита 50-60°С, iк = 0,5 ÷ 1,0 А/дм2, аноды — из бронзы (10—15% Sn) пли разделенные с соотношением
SCu:SSn= 1:1. Получаемые покрытия содержат 12—20% Sn.
Равновесные потенциалы меди в цианидферратном электролите и олова в станнатном приблизительно одинаковы, благодаря чему облегчается их восстановление. На поляризационной кривой (бронза при 60 °С) наблюдаются (рис. 50) два перегиба; один при iк = 0,75 А/дм2 и второй — при iк = 3,5 А/дм2. Первый соответствует восстановлению меди в цианидферратном электролите при iк = 0,5 А/дм2, а второй связан с обеднением прикатодного слоя разряжающимися ионами олова. В связи с этим поляризационная кривая до первого перегиба определяет совместное катодное соосаждение меди и олова (золотистые осадки). Кривая выше этого перегиба характеризует выделение на катоде только олова (серые осадки), кривая выше второго перегиба соответствует выделению водорода.
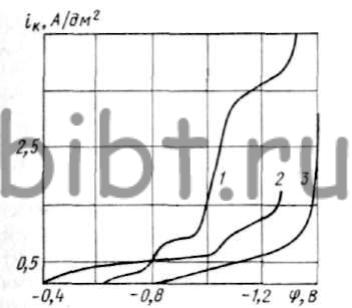
Рис. 50. Кривые катодной поляризации Cu — Sn (1), меди (2) и олова (3) в электролите:
1 — основной состав; 2 — 30 г/л CuCl, 200 г/л K4Fe(CN)6 и 20 г/л К2СО3; 3 - 4 г/л Sn, 17 г/л NaOH, 20 г/л К2СО3 и 200 г/л K4Fe(CN)6 (температура электролита 60 °С, частота вращения мешалки 500 об/мин)
Анодные поляризационные кривые для олова имеют два перегиба (рис. 51) и три ветви. Первый перегиб соответствует образованию пассивной пленки при iа = 0,4 А/дм2. Ветвь выше этого перегиба характеризует процесс электрохимического растворения анода в условиях частичной пассивации, когда растворение с образованием Sn (II) сменяется образованием ионов Sn (IV). Второй перегиб при ia = 1,5 А/дм2 соответствует переходу анода в полное пассивное состояние.
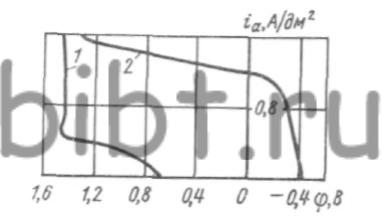
Рис. 51. Кривые анодной поляризации олова (1) и меди (2). Температура электролита 60 °С, частота вращения мешалки 500 об/мин
Присутствие в электролите ионов Sn2+ приводит к образованию темных и шероховатых покрытий, поэтому для бронзирования оловянные аноды следует пассивировать посредством погружения в рабочий электролит при iа=2 А/дм2. Медный анод в цианидферратном электролите работает с небольшой поляризацией (~0,15 В при iа = 0,6 А/дм2). Резкое его пассивирование наступает при iа = 1,0 А/дм2. Поэтому наиболее оптимальным является соотношение SCu: SSn = 2:1, при этом SCu должно равняться Sк.
Покрытия белой бронзой получают из электролита (в г/л):
Станнат натрия 25 — 30
Медь цианистая 8—10
Натрий цианистый (свободный) 17 — 25
Натр едкий (свободный) 8—10
Режим электролиза: температура электролита 60-70°С, iк=1,5 ÷ 2,0 А/дм2, аноды - из коррозионно-стойкой стали 12Х18Н9Т, скорость осаждения ~ 15 —18 мкм/ч. Состав получаемых осадков: 40-50% Sn и 55-60% Cu. Такие покрытия в основном применяют для замены серебряных покрытий на деталях радиоаппаратуры.
Для декоративных целей белую бронзу осаждают из пирофосфатного электролита, в котором соотношение Cu2+ :Sn2+ =100:120, а содержание К4Р2O7 (свободный) равно 300 - 350 г/л. Режим электролиза: температура электролита 20-30°С, iк = 0,5 ÷ 1,0 А/дм2, рН = 7 ÷ 8, аноды — из коррозионно-стойкой стали или бронзы.
С увеличением относительной концентрации меди, а также суммарной концентрации обоих компонентов в электролите содержание меди в сплаве возрастает и ηк сплава увеличивается.
С повышением iк содержание меди в покрытии уменьшается, но при iк = 0,25 А/дм2 стабилизируется. При iк = 0,5 А/дм2 скорость осаждения составляет ~ 10 мкм/ч. С повышением температуры электролита значительно увеличивается содержание меди в сплаве. При 60°С сплав содержит 8— 12% олова, а при 20 °С 40-50%. Уменьшение рН от 9,5 до 7,5 не влияет на состав сплава. Однако при рН = 6,6 и низких значениях iк содержание меди в сплаве увеличивается. Это связано с тем, что с уменьшением рН на катоде разряжаются преимущественно ионы Cu(Р2O7)2-2, а с увеличением рН — ионы Cu(P2O7)6-2.
Покрытия белой бронзой характеризуются износостойкостью в 4 раза большей, чем серебряных покрытий, устойчивостью против атмосферной коррозии, высоким коэффициентом отражения (60 — 65%) и отсутствием потемнения при контакте с серосодержащими материалами. Однако их термостойкость не выше 200° С.
Блестящие покрытия Cu — Sn (желтые и белые) восстанавливают на катоде из цианисто-станнатного электролита (в г/л):
Na2SnO3 10 — 50
CuCN 10-45
NaCN (свободный) 10 — 35
NaOH (свободный) 3 — 5
Натрий лимоннокислый 10 — 45
Режим электролиза: температура электролита 30-50 °С, iк=0,5÷1 А/дм2, аноды — из бронзы или платинированного титана. Желтые осадки Cu—Sn имеют микротвердость ~300 кгс/мм2, а белые => 500 кгс/мм2. Высокая твердость белых бронз объясняется образованием интерметаллического соединения типа Cu6Sn3. В количестве блескообразователей при осаждении Cu — Sn из цианистых электролитов применяют добавки диэтилентриамина (20 — 30 г/л) и сегнетовой соли (40 — 50 г/л).