
| Главная |
| Поиск по сайту |
Адрес этой страницы' ?>
<<Предыдущая страница Оглавление книги Следующая страница>>
КАТОДНОЕ ВОССТАНОВЛЕНИЕ ПОКРЫТИЙ ЖЕЛЕЗОМ
Железнение (осталивание)
Зависимость выхода по току и твердости осадков железа от скорости протекания электролита
Катодное восстановление покрытий железом
Железнение (осталивание) в большинстве случаев применяют для восстановления размеров дорогостоящих деталей, а также для получения коррозионно-стойких покрытий. Решающим фактором при железнении стальных деталей является прочное сцепление покрытия с основой.
При подготовке под покрытие перлит растворяется медленнее, чем мартенсит или троостит, которые, вытесняя водород из электролита, вступают во взаимодействие с кислородом. Но поскольку в поверхностном слое закаленной стали образуется плотная пленка окислов, то она почти не травится в сильноразбавленных кислотах до тех пор, пока не разрушится, после чего растворение такой стали идет беспрепятственно.
Для износостойкого железнения деталей применяют электролит (в г/л):
FeCl2•4H2O 300-330
HCl 1,5-2
Режим электролиза: температура электролита 75 —80°С, iк = 3÷5 А/дм2, соотношение Sa:Sк = 1:1 ÷ 2:1, аноды — стальные полосы в чехлах из стеклоткани марки ТСФ-9л.
В ванне железнения детали выдерживают без тока в течение 10 — 30 с с целью прогрева и разрушения пассивной пленки. Затем подвеску с деталями устанавливают на катодной штанге при iк = 3 ÷ 5 А/дм2, и в течение 10 мин значение iк доводят до расчетной (10 — 20 А/дм2). После осталивания детали промывают в горячей воде, нейтрализуют в 5— 10%-ном растворе каустической соды и снова промывают в горячей воде.
Кислотность электролита корректируют с учетом того, что за 1 А/ч расходуется 0,8 г кислоты.
Для износостойкого железнения применяют электролит с рН =0,1, содержащий FeCl2•4H2O (450-500 г/л). Режим электролиза: температура электролита 40- 80°С, iк = 5 ÷ 20 А/дм2, аноды стальные.
С повышением температуры уменьшается наводораживание и увеличивается выход по току газообразного водорода, выделяющегося в виде пузырьков на катоде. С ростом температуры увеличиваются размеры области когерентного рассеяния, уменьшается плотность дислокации и размеры микроискажений покрытий железа.
Несмотря на то, что водородное перенапряжение снижается с ростом температуры, наводораживание осадка уменьшается, что связано с изменением адсорбции водорода на поверхности растущих кристаллов. С повышением температуры блокирующее влияние водорода уменьшается, размеры когерентного рассеяния увеличиваются, а плотность дислокаций и микроискажения уменьшаются. Другой причиной, облегчающей условия формирования осадка, является уменьшение перенапряжения для железа с повышением температуры.
Увеличение iк способствует уменьшению наводораживания. С увеличением рН уменьшается выход по току газообразного водорода, что связано с уменьшением концентрации ионов гидроксила у катода. Таким образом, водород является одним из основных факторов, влияющих на формирование осадка, и препятствует росту кристаллов, измельчая субмикроструктуру.
Перспективным является проточное осталивание деталей в электролите, содержащем 650 г/л хлористого железа при 80°С. Скорость протекания электролиза в пространстве между анодом и катодом составляет < 15 см/с. Концентрация соляной кислоты равна 2-2,5 г/л, iк = 40 ÷ 60 А/дм2, расстояние между анодом и катодом составляет 2,5 мм.
На катодную поляризацию существенно влияет скорость протекания электролита (рис. 26). Из проточного электролита осаждение железа происходит при бо'льших положительных значениях потенциала, чем в непроточном. Причиной этого служит уменьшение защелачивания прикатодного слоя, что приводит к уменьшению количества образующейся гидроокиси железа и созданию условий для более интенсивного разряда ионов железа и применения более высоких плотностей тока.
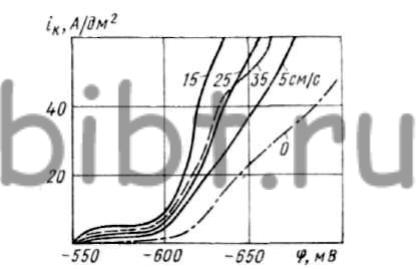
Рис. 26. Зависимость катодной поляризации (2,56 г/л НСl) от скорости протекания электролита
С увеличением скорости движения электролита от 0 до 5 см/с средний выход по току возрастает до 97,6% против 87,9% в стационарных условиях (рис. 27). С изменением скорости движения электролита от 5 до 25 см/с твердость покрытия составляет 440 — 500 кгс/мм2 и максимальна при 25-35 см/с. При стационарном режиме и iк = 20 А/дм2 твердость равна 300 — 400 кгс/мм2.
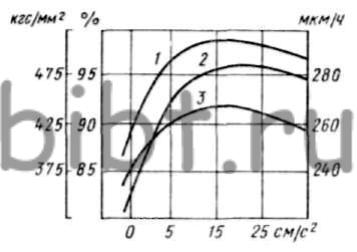
Рис. 27. Зависимость выхода по току и твердости осадков железа от скорости протекания электролита (iк = 20 А/дм2; температура 80°С, содержание HCl равно 2,0 г/л): 1 — выход по току; 2 — твердость; 3 — скорость осаждения (мкм/ч)
Мягкие и блестящие покрытия железом применяют в некоторых случаях как подслой под кобальт, никель или хром. Наибольшее использование нашел для этой цели электролит (в моль/л)
FeSO4•7H2O 0,5
H2SO4 0,0375
Н3ВО3 0,5
(C2H5)NH•HCl 2
Режим электролиза: температура электролита 18-30°С, iк = 1 ÷ 3 А/дм2, аноды — из железа. Микротвердость таких осадков 280 — 320 кгс/мм2. Катодный выход покрытия железом составляет 93—95%, а анодный 100%; рН электролита должно поддерживаться в пределах 2,7 — 2,9.
В процессе электролиза на аноде возможно окисление Fe2+ до Fe3+, что вызывает пятнистость или почернение катодных осадков и появление на аноде легко снимаемого шлама, поэтому аноды следует помещать в чехлы из хлорина или стеклоткани. Наилучшие результаты получают при использовании анодов из армко-железа или стали, содержащей не более 1% углерода.
Не менее перспективным для блестящего железнения является электролит (в г/л):
Fe(SO3NH2)2 120-150
Н3ВО3 25-30
Диэтаноламин 0,1
Моющее средство «Прогресс», мл/л 0,4
Режим электролиза: температура электролита 18-20°С, iк = 4 ÷ 10 А/дм2, аноды из армко-железа, рН = 1,65.
Перемешивание электролита сжатым воздухом недопустимо, так как это приводит к окислению. Микротвердость покрытий, получаемых при iк = 2 ÷ 5 А/дм2, составляет 220 — 250 кгс/мм2, а блеск 60-70%.