
| Главная |
| Поиск по сайту |
Адрес этой страницы' ?>
<<Предыдущая страница Оглавление книги Следующая страница>>
ПОКРЫТИЯ СПЛАВАМИ НА ОСНОВЕ ЖЕЛЕЗА
Электролит для гальванических покрытий Fe — Cr.
Покрытия сплавами на основе железа
Хромистые стали обладают (10 — 30% Cr) высоким сопротивлением окислению и коррозии. Для гальванических покрытий Fe — Cr применяют электролит (в г/л):
Cr2(SO4)3•5H2O 160
FeSO4•7H2O 30-50
NH2CH2COOH 150
H2CrO4 0,5
Режим электролиза: температура электролита 20°С, рН = 2,3, iк = 7 ÷ 12 А/дм2, ηк = 20 ÷ 26%, анод - из стали 12X17. Готовый электролит следует прокипятить и проработать в течение 3 — 5 дней, так как образование комплекса хрома с гликоколем требует определенного времени.
Для приготовления электролита в дистиллированной воде растворяют сульфат хрома зеленой модификации, добавляют гликоколь и полученный раствор кипятят в течение 30 мин, затем охлаждают и добавляют FeSO4. Буферные свойства электролита в процессе работы не ухудшаются, так как гликоколь обеспечивает сохранение нужной кислотности. С увеличением концентрации Cr2(SO4)3 содержание хрома в сплаве увеличивается от 4 до 22%, а ηк падает от 65 до 35%.
С увеличением FeSO4•7H2O при тех же условиях электролиза содержание железа в сплаве увеличивается от 60 до 90%, ηк возрастает до 44%, но качество покрытий ухудшается. При содержании железа в сплаве, равном 85—90%, покрытие темнеет на воздухе и при толщинах 15—20 мкм отслаивается от подложки. Наилучший состав сплава Fe — Cr обеспечивается при 25-35% хрома.
По мере увеличения концентрации Fe3+ в растворе содержание хрома в сплаве падает, a ηк возрастает вследствие восстановления части Fe3+ до Fe2+ ионами Cr2+ за счет неполного восстановления Cr3+ на катоде и увеличения общей концентрации железа в растворе. С повышением температуры относительное содержание хрома в сплаве уменьшается, и покрытия становятся темными. При увеличении плотности тока ηк и содержание хрома в сплаве возрастают, однако при iк>12 А/дм2 в покрытиях толщиной => 20 мкм имеются значительные микротрещины.
Для предупреждения гидролиза трехвалентных солей железа, образующихся при окислении Fe2+ кислородом воздуха, в электролит добавляют щавелевую кислоту. Микротвердость покрытий Fe — Cr составляет 550 — 600 кгс/мм2. Испытания покрытий железо — хром в тумане 3%-ного раствора NaCl при 30°С указывает на то, что эти покрытия имеют более высокую стойкость к коррозии, чем электролитическое железо.
При совместном осаждении обоих металлов (рис. 28) скорость восстановления ионов хрома несколько повышается, а железа — резко уменьшаеется. Это объясняется тем, что при наличии соли хрома в электролите ηк снижается за счет облегчения выделения водорода. Потенциал выделения водорода на сплаве ниже, чем на чистом железе.
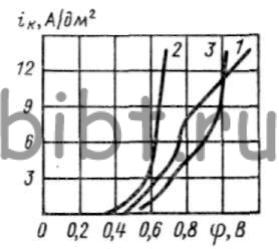
Рис. 28. Кривые катодной поляризации (совместно с Н2):
1 — хрома из электролита, содержащего Cr2(SO4)3 (130 г/л) и NH2CH2COOH (150 г/л); 2 — железа из электролита, содержащего FeSO4 (27 г/л) и NH2CH2COOH (150 г/л); 3 — сплава Fe — Cr из электролита, содержащего Cr2(SO4)3 (130 г/л); FeSO4 (27 г/л) и NH2CH2COOH (150 г/л)
Для изготовления анодов вместо стали 12X17 можно применять магнетит. Свинец не рекомендуется использовать, так как он окисляется, что приводит к резкому ухудшению качества осадков и снижению ηк. Анодные потенциалы стали 12X17 и магнетита даже при малых iа сдвигаются в область положительных значений (рис. 29). С повышением iа скорость растворения анодов уменьшается и достигает минимума при 7 А/дм2, что связано с пассивацией поверхности анодов. При более высоких значениях ia растворение анодов увеличивается за счет механического разрушения пассивной пленки пузырьками кислорода.
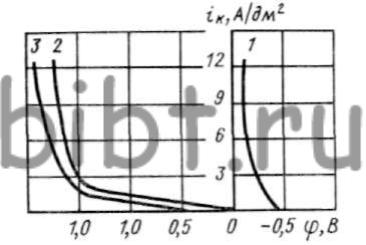
Рис. 29. Кривые анодной поляризации армко-железа (1), стали 12X17 (2) и магнетита (3) в электролите, содержащем FeSO4 (27 г/л), Cr2(SO4)3 (130 г/л) и NH2H2COOH (150 г/л)
Скорость растворения анода из стали 12X17 значительно выше, чем анода из магнетита, при прочих равных условиях электролиза (рис. 30).
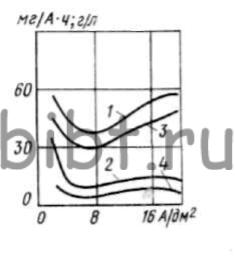
Рис. 30. Зависимость скорости растворения анода и концентрации металлов в электролите от анодной плотности тока; 1-сталь 12X17; 2 — магнетит; 3, 4 — концентрация железа и хрома в электролите
С увеличением iа количество хрома в электролите практически остается без изменения, концентрация железа имеет минимальное значение при iа≈8 А/дм2.
Сплав Fe - Cr — Ni, содержащий 8 -17% Cr и 13-20% Ni (остальное Fe), осаждают из электролита (в г/л):
FeSO4•7H2O 50-60
Cr2(SO4)3•15H2O 250-280
NiSO4•7H2O 100-110
Мочевина 150-180
Н3ВО3 25
Режим электролиза: температура электролита 50°С, рН = 2,1, iк = 6÷16 А/дм2, анод — из платины, ηк = 15 ÷ 25%.
Для осаждения сплава Fe — Cr — Ni, содержащего 19-25% Cr, 6-7% Ni (остальное — железо) применяют электролит (в г/л):
FeSO4(NH4)2SO4•6H2O 35-40
KCr(SO4)2•12H2O 310-400
NiSO4•7H2O 50-60
Нитрат натрия 60 — 70
Фторид натрия 5—10
Режим электролиза: температура электролита 35-40°С, рН = 1,6÷1,8,
iк = 15 ÷ 20 А/дм2, аноды — из стали хромоникелевой, ηк = 35÷45%.
Для осаждения сплава Fe — Cr — Ni, применяют электролит (в г/л):
FeSO4•7H2O 29-46
Cr2(SO4)3•5H2O 140-160
NiSO4•7H2O 55-85
Сульфаминовая кислота 220 — 250
Режим электролиза: температура электролита 20-30°С, рН = 1,4÷1,6, iк = 5 ÷10 А/дм2, аноды — из графита, ηк = 18÷25%. Состав сплава: 18-25% Cr, 12% Ni, остальное — железо.
Хлоридный электролит используют для осаждения сплава Fe — Cr — Ni (7-20% Cr, 5-30% Ni, остальное-железо). Электролит содержит (в г/л):
FeCl2•4H2O 20-40
CrCl3•10Н2О 160-180
NiCl2•6H2O 25-70
NH4Cl 200
Режим электролиза: температура электролита 20-30°С, рН = 2,0, iк = 10 ÷ 30 А/дм2, ηк = 30 ÷ 40%, аноды — из платины.
При увеличении содержания солей металлов в электролите количество железа в сплаве увеличивается, а хрома и никеля уменьшается. В хлоридном электролите при этом увеличивается содержание хрома в осадках. С увеличением содержания никеля в сульфатном и триэтаноламинном электролитах увеличивается и его количество в осадках.
Для осаждения сплава Fe — Cr — Ni (с малым содержанием железа) за рубежом применяют электролит (в г/л):
NiSO4 150-200
CrO3 200-250
FeSO4 50-70
СаСO3 50-60
CaSO4•2H2O 10-15
Режим электролиза: температура электролита 20° С. iк = 10÷40 А/дм2, аноды — из платинированного титана или свинца. Состав покрываемых осадков: 6-10% Fe, 0,5-1% Ni, остальное — хром.
Перемешивать такой электролит нежелательно, так как при этом увеличиваются внутренние напряжения в покрытиях и ухудшается их адгезия к подложке. Сульфат кальция повышает рассеивающую способность и предотвращает растрескивание покрытий, а СаСO3 способствует увеличению электропроводимости раствора.
С повышением iк и температуры электролитов (кроме сульфатного) увеличивается ηк. При толщине покрытий > 6 мкм их адгезия ухудшается. На никеле и хроме адгезия покрытий Fe — Ni — Cr лучше, чем на стали. Отжиг покрытий при 1100°С в атмосфере аргона снижает их пористость. В качестве добавок, уменьшающих водородную хрупкость, применяют сахарин (0,2 — 0,3 г/л) и Н-толуолсульфонамин (0,25 г/л).
Известен электролит (в г/л):
K2Cr2(SO4)2 350-500
NH2CH2COOH 75-150
FeSO4 30-40
NiSO4 70-90
Режим электролиза: температура электролита 20°С, iк = 1 ÷ 20 А/дм2, рН = 2 ÷ 2,2, аноды — из стали 12Х18Н9Т. Покрытие Fe - Cr - Ni содержит 15-34% Cr, 5-10% Ni, остальное — железо.
На рис. 31 представлена катодная поляризация сплава и восстановления Fe, Cr, Ni. Зависимости внутренних напряжений от iк, их микротвердости и содержания хрома в покрытиях даны на рис. 32 и 33.
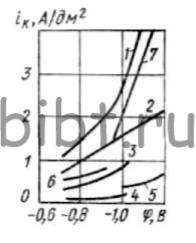
Рис. 31. Кривые катодной и парциальных поляризации (без учета водорода рН = 2÷2,2; температура электролита 20°С): 1 — сплава Fe — Cr — Ni; 2 — железа; 3 — хрома; 4 — никеля; 5 — хрома из электролита без солей железа и никеля; 6 — никеля из раствора NiSO4 (460 г/л): 7 - железа из раствора FeSO4 (60 г/л)

Рис. 32. Зависимость твердости осадков от содержания хрома в сплаве
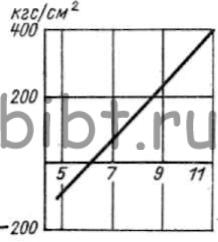
Рис. 33. Зависимость внутренних напряжений от плотности тока
Микротвердость покрытий возрастает с увеличением количества хрома и достигает 650 кгс/мм2 для сплава, содержащего 30% Cr и 8% Ni. Все покрытия имеют микроструктуру с размером зерен 10-5 — 10-6 см. После отжига при 1100°С покрытия Fe — Ni — Cr рекристаллизуются и становятся немагнитными.