
| Главная |
| Поиск по сайту |
Адрес этой страницы' ?>
<<Предыдущая страница Оглавление книги Следующая страница>>
Зависимость катодной поляризации серебра от металла катода
Кинетика осаждения серебра в цианистых электролитах.
Механизм восстановления цианистых комплексов серебра на катоде изучен не до конца. На основании исследований поляризационной кривой (рис. 75) и качества получаемых покрытий серебра при различных плотностях тока получено, что на I участке при φ = - (0,4 ÷ 0,45) В (iк = 0,3 ÷ 0,5 А/дм2) в основном на катоде происходит разряд комплекса [Ag(CN)2]- по схеме
[Ag(CN)2]- -> AgCN + CN-
AgCN ->Ag+ +CN- и т.д.
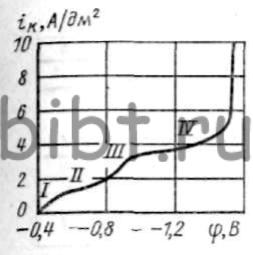
Рис. 75. Кривая катодной поляризации серебра
При больших концентрациях свободного цианида происходит восстановление серебра из аниона [Ag(CN)3]2-. На II участке (φ = -(0,5 ÷ 0,65) В и iк = 0,6 ÷ 1 А/дм2) вместе с серебром на катоде восстанавливается и водород:
H3O+ -> H+ + H2O
[Ag(CN)2]- -> AgCNколл + CN-AgCNколл + H+ + H2O -> Ag + H3O+ + CN-.
На III и IV участках вместе с серебром в большей степени выделяется водород по схеме
Н + Н -> Н2.
На IV участке (φ= -(1,4 ÷ 1,6) В и iк => 4 А/дм2) на катоде выделяется только водород.
Наиболее качественные покрытия серебра, пригодные для практических целей, даже при высокой концентрации серебра в цианистых электролитах получаются только при потенциалах, соответствующих первым двум участкам поляризации (φ => —0,65 В). При φ <= —0,75 В покрытия становятся темными и шероховатыми.
Определяющим фактором при катодном восстановлении серебра является концентрация комплексообразователя. В электролите, не содержащем ионы серебра, изменение концентрации цианида от 20 до 100 г/л (рис. 76) практически не влияет на ход катодных поляризационных кривых и лишь постепенно сдвигает равновесный потенциал в сторону отрицательных значений (от —0,6 до —0,7 В).
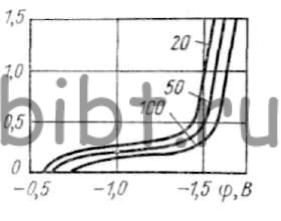
Рис. 76. Кривые катодной поляризации серебра в растворах KCN при различной концентрации цианида
Не менее важным фактором, влияющим на кинетику катодного восстановления серебра, является природа вводимой в электролит серебряной соли. Так, при введении AgCN и Ag2O (рис. 77) кривая поляризации не имеет перегибов (кривые 4 и 10), свойственных кривым катодной поляризации из электролитов, содержащих цианистый комплекс серебра и свободный цианид (кривая 2). Она также не имеет площадок I и II предельного тока. Отсутствие первого объясняется тем, что происходит постоянное и равномерное снабжение серебром прикатодного слоя за счет растворения Ag2O или AgCN. Отсутствие второго предельного тока связано с тем, что при непосредственном восстановлении серебра из нейтральных молекул Ag2O или AgCN, гидратированных молекулами воды, на катоде не происходит перестройка двойного слоя.
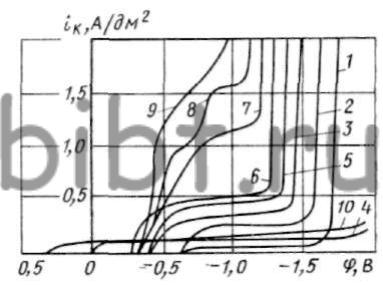
Рис. 77. Кривые катодной поляризации серебра в цианистых электролитах:
1-10 г/л KCN; 2-10 г/л KAg(CN)2 и 10 г/л KCN; 3-10 г/л KAg(CN)2; 4-40 г/л Ag2O; 5-40 г/л Ag2O и 10 г/л KCN; 6-40 г/л Ag2O и 20 г/л KCN; 7-40 г/л Ag2O; 8-65 г/л KAg(CN)2; 9 - 40 г/л Ag2O и 60 г/л KCN; 10 - 40 г/л AgCN
Перемешивание и повышенная температура электролита также способствуют сдвигу равновесных потенциалов и изменению катодной поляризации. Но с цианистыми электролитами практически работают без применения перемешивания и повышенных температур, что связано с их токсичностью, а также ухудшением качества получаемых покрытий.
Помимо перечисленных факторов необходимо отметить влияние природы покрываемого металла (рис. 78). На медном катоде восстановление серебра начинается сразу после включения тока и постепенно распределяется по всей поверхности катода.
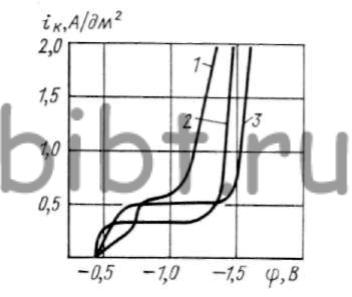
Рис. 78. Зависимость катодной поляризации серебра от металла катода:
1 — сталь 20; 2 — медь анодная; 3 — серебро анодное
На стали в момент включения внешней цепи катодное восстановление серебра не наблюдается. Начиная с φ = -0,6 В на катоде появляются первые пузырьки водорода и происходит скачок потенциала и видимое восстановление серебра при φ = = -0,75 В.
На механизм восстановления серебра из цианистых электролитов оказывает влияние и анодный процесс (рис. 79). Пассивация поверхности анода наступает при φ > +0,2 В и тем интенсивнее, чем выше анодная плотность тока. В начале появляется коричневая пленка, в основном состоящая из Ag2O, затем на аноде образуется более плотная пленка из AgO (φ = +0,6 В). При потенциалах выше + 0,8 В на аноде образуется Ag2O3 и он практически становится нерастворимым. Таким образом, начиная с φ => +0,3 В, анодный процесс может являться сдерживающим фактором в восстановлении серебра на катоде.
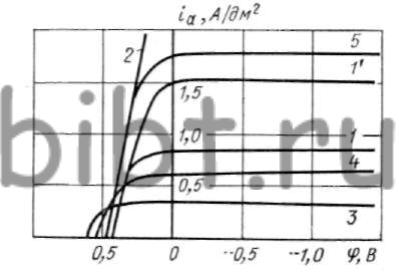
Рис. 79. Кривые анодной поляризации серебра в цианистых электролитах (обозначения см. таблицу)

При применении нерастворимых анодов (платина, платинированный титан, сталь 12Х18Н9Т) пассивное поведение серебра в первую очередь связано с термодинамической неустойчивостью электролита, при определенных значениях рН и потенциалов (рис. 80).
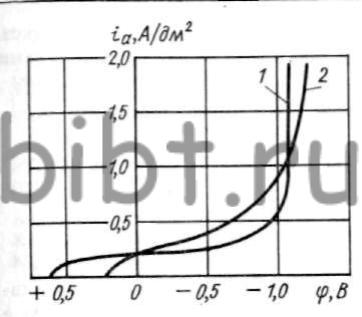
Рис. 80. Кривые анодной поляризации на платине (1) и стали 12Х18Н9Т (2) (состав электролита № 3 см. рис. 79)
Сравнение кривых катодной и анодной поляризации серебра (рис. 81) показывает, что соответствие ηк и ηa наблюдается только при повышенной концентрации ионов серебра и свободного цианида в электролите при iк = 0,5 ÷ 0,7 А/дм2.
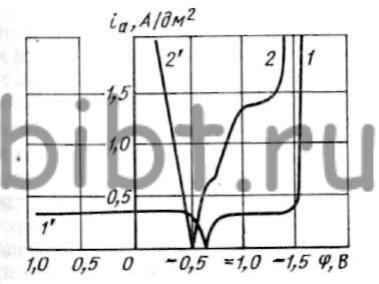
Рис. 81. Кривые катодной 1 (№ 2) и 2 (№ 1) и анодной (1' и 2') поляризации серебра (составы электролитов см. рис. 79)
Наиболее приемлемым составом цианистого электролита серебрения является следующий (в г/л):
KAg(CN)2 60-65
KCN (свободный) 50-60
Практика работы с цианистыми электролитами серебрения указывает на то, что соотношение свободного цианида к комплексу серебра в электролите должно составлять от 1,0 : 1,0 до 0,8 :1,0, а соотношение Sа: Sк от 0,75 : 1
Помимо цианистых электролитов применяют такие электролиты серебрения, как цианидферратный, цианидар-гентатнороданидный, дицианоаргентатнороданидный, а также указанные электролиты с добавками этилендиами-на, полиэтиленполиамина и других веществ, облегчающих анодный процесс и способствующих получению более качественных покрытий.