
| Главная |
| Поиск по сайту |
Адрес этой страницы' ?>
<<Предыдущая страница Оглавление книги Следующая страница>>
ВОССТАНОВЛЕНИЕ ИОНОВ ВОДОРОДА ПРИ КАТОДНОМ ВОССТАНОВЛЕНИИ МЕТАЛЛОВ И СПЛАВОВ
Зависимость перенапряжения от порядкового номера металла.
Восстановление ионов водорода при катодном восстановлении металлов и сплавов.
При катодном восстановлении большинства металлов из водных растворов происходит выделение водорода (от небольших долей до десятков процентов от общей катодной реакции). Катодные брутто-реакции выделения водорода из кислых и щелочных растворов могут быть представлены в следующем виде:
Н3О+ + ē -> 0,5 Н2 + Н2O
Н2О + ē -> 0,5Н2 + OH-.
Если бы эти реакции протекали обратимо на любых катодах, то из водных растворов не могли бы восстанавливаться многие металлы, стандартный потенциал которых отрицательнее потенциала восстановления водорода.
Разряд ионов водорода зависит от металла катода, плотности тока, температуры, состава электролита, значения рН и других условий электролиза и обусловливается трудностями прохождения следующих стадий катодной реакции:
1) транспортирование водородных ионов или их доноров к поверхности катода (к двойному электрическому слою);
2) разряд ионов водорода на катоде, т. е. освобождение протонов от сольватных связей Hs+ и присоединение их к поверхности металла адсорбционными связями с одновременной их электронейтрализацией:
Нs+ + ē -> Hад,
где Над — адсорбированный атом водорода; как и в случае электроосаждения металлов, эта стадия называется реакцией перехода;
3) образование молекул Н2 на поверхности металла без разрыва адсорбционных связей, идущее по двум реакциям:
Над + Над -> Н2ад или
Над + Н++ē -> Н2ад
(первая реакция Тафеля, а вторая реакция Гейровского);
4) десорбция адсорбированных молекул Н2ад с поверхности металла и переход их в ближайший слой электролита;
5) десорбция молекулярного водорода Н2 из прикатодного слоя в глубь раствора путем диффузии или в атмосферу в виде пузырьков газа.
При совместном разряде ионов Н+ с ионами металлов лимитирующими стадиями являются 2 и 4.
Независимо от лимитирующей стадии катодной реакции перенапряжение для разряда ионов водорода аналогично переходному перенапряжению для разряда ионов металла описывается уравнением Тафеля:
η= а + b log [i],
где а и b — константы, первая из которых характерна для каждого металла, а вторая обычно имеет значение, близкое к 0,116, иногда оно снижается до 0,086 или повышается до 0,14. В случае небольших и средних перенапряжений можно применять уравнение электрохимической кинетики:
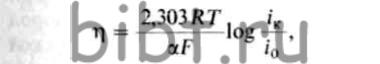
где α — коэффициент переноса; iк — плотность катодного тока; i0 — ток обмена ионов водорода на данном металле.
Для практических подсчетов можно принять α = 0,5 и перенапряжение η для выделения водорода на разных металлах выразить через ток обмена, который может изменяться от —1,25 до —12,9 А/см2. Кроме того, для одного и того же металла его значения могут быть различными в зависимости от рН электролита и подготовки электрода. Логарифм тока обмена является периодической функцией порядкового номера металла в таблице Д. И. Менделеева. С увеличением порядкового номера элемента log i0 постепенно возрастает и достигает максимума для металла VIII группы подгруппы железа, а также для тех металлов, которые имеют незаконченные d-оболочки электронов (пять — девять электронов). Для металлов, имеющих законченные d-оболочки до 10 электронов, токи обмена водорода являются минимальными.
При периодических изменениях тока обмена водорода изменяется и каталитическая активность металлов (чем выше значения log i0, тем сильнее проявляется эта активность).
В случае катодного восстановления металлов при комнатной температуре последнее уравнение имеет вид η =0,116 log iк - 0,116 log i0, откуда следует, что при малых плотностях токов катодной поляризации перенапряжение для разряда ионов Н+ на всех металлах является относительно малой величиной. Например, если ток катодной поляризации даже на целый порядок выше тока обмена (iк = 10 i0), то перенапряжение η для всех металлов достигает одинакового значения (~ 0,1163).
Следовательно, при низких плотностях тока катодной поляризации ионы водорода в кислых растворах могут начать разряжаться раньше, чем ионы тех металлов, стандартные потенциалы которых по своим значениям отрицательнее, чем потенциал водорода.
Независимо от значения рН в кислых растворах, имеющих значительную концентрацию солей металлов, ионы водорода быстро исчерпываются в ближайшем прикатодном слое, и для разряда ионов Н+ достигается предельный ток, имеющий относительно низкие значения. Поскольку в условиях предельного тока для выделения водорода рН среды в ближайшем прикатодном слое лимитируются концентрацией гидроокисей осаждаемых металлов, то разряд их ионов всегда происходит в сильно щелочной среде. Это приводит к тому, что у поверхности катода резко снижается концентрация ионов осаждаемого металла и быстро появляется предельный ток.
Включение водорода в покрытия и металл подложки в основном происходит путем адсорбции, а не объемного поглощения. Так, например, адсорбция водорода на никеле протекает быстро. Обычно диффузия водорода в металл идет вдоль границ между зернами, в плоскости сращивания кристалла и сквозь кристаллическую решетку. Проникновение атомов водорода через кристаллическую решетку может происходить посредством диффузии атомов водорода через промежутки между узлами решетки и по пустым местам решетки.
Атомарный водород способен растворяться в металлах. Под растворением подразумевается количество адсорбированного в металл водорода (твердые растворы, химические соединения и др.). В случае образования химического соединения между водородом и металлом поглощение водорода значительно больше, чем при простом растворении (табл. 15).
15. Растворимость водорода в металлах при 20°С
| Металл | Растворимость, см3/г |
| Nb | 55 |
| Та | 125 |
| Ti | 403 |
| V | 150 |
| Ni | 0,05 |
| Fe | <0,5 |
| Со | <0,05 |
Степень наводораживания зависит от природы металла покрытия и его структуры (табл. 16).
16. Степень наводораживания металла
| Металл | Степень наводораживания, % по объему |
| Sn | 5-12 |
| Ni | 79 |
| Fe | 780-6000 |
| Zn | 2000 |
| Cr | => 200000 |
Так, содержание водорода в углеродистой стали зависит от ее структуры: мартенсит - 0,907 см3/г, троостит - 0,016 см3/г, сорбит -0,046 см3/г. С увеличением iк увеличивается поверхностная концентрация атомов водорода, что повышает вероятность попадания его в осадки. Так, например, количество водорода в осадках марганца (из сернокислого электролита) при iк = 20 А/дм2 составляет 4,8 см3/г, а при iк = 50 А/дм2 5,4 см3/г. С большинством металлов водород образует гидриды с металлической связью, обеспечиваемой подвижными электронами, что определяет высокую тепло- и электропроводность этих соединений.
Перенапряжение водорода, а следовательно, и скорость восстановления возрастают (табл. 17).
17. Перенапряжение выделения водорода
| iк, А/см2 | Re | Pd | Au | W | Mo | Ni | Co | Ag | Cr | Fe | Ge | Та |
| В 2NH2SO4 | ||||||||||||
| 10-3 | 0,12 | 0,14 | 0,24 | 0,26 | 0,35 | 0,30 | 0,32 | 0,35 | - | 0,37 | 0 39 | 0,46 |
| 10-2 | - | - | 0,39 | 0,37 | 0,50 | 0,50 | 0,39 | 0,43 | - | 0,46 | 0,62 | 0,55 |
| В 2NHCl | ||||||||||||
| 10-3 | 0,48 | 0,51 | 0,57 | 0,58 | 0,63 | 0,65 | 0,69 | 0,8 | 0,83 | 1,04 | 1,05 | 1,12 |
| 10-2 | 0,60 | 0,71 | 0,71 | 0,68 | - | - | 0,83 | - | 1,01 | 1,15 | - | 1,24 |
| 10-1 | 0,74 | 0,93 | 0,83 | 0,76 | - | - | 0,91 | - | 1,17 | 1,21 | - | 1,26 |
Задержка восстановления металла на наводороженном катоде (железо, никель и др.) объясняется и тем, что, внедряясь в кристаллическую решетку металлов, водород образует соединение типа Мē- - Н2+, положительный заряд которого направлен в сторону электролита. Между перенапряжением водорода и положением металла в периодической системе Менделеева имеется определенная связь (рис. 8). Исключение составляют Cu, Ag, Au и Hg. По всей вероятности это объясняется особенностью их строения. Хотя d — уровень достроен, но s — уровень следующего слоя содержит один электрон, что и является причиной неустойчивости d-уровня и отличия перенапряжения на этих металлах от других металлов с заполненным d-уровнем.
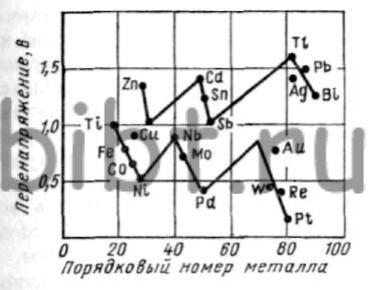
Рис. 8. Зависимость перенапряжения от порядкового номера металла
На практике применяют различные способы снижения степени наводораживания и улучшения качества электроосадков: в электролит вводят посторонние органические и неорганические добавки; используют блескообразователи, а также ультразвук; механически перемешивают электролит и др.